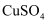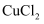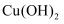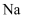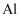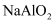第一节 硫及其化合物 知识点题库
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为( )
A . BaSO4
B . BaSO3
C . BaS
D . BaSO4和BaSO3
如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( )

A . 使用此装置处理过的废气就不会对大气造成污染了
B . 装置内发生的反应有化合、分解、置换和氧化还原反应
C . 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2
D . 可用澄清的石灰水检验经过处理的废气是否达标
下列现象或事实可用同一原理解释的是( )
A . 铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象
B . 氢氟酸和氢氧化钠溶液都能溶解二氧化硅
C . 次氯酸和二氧化硫都具有漂白作用,能使品红溶液褪色
D . H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率
下列说法正确的是( )
A . S在纯氧中燃烧可生成SO3
B . 用澄清石灰水可鉴别CO2和SO2
C . SO2能使KMnO4溶液褪色
D . CO2通入CaCl2溶液中能产生白色沉淀
将足量SO2通入下列溶液中,能产生浑浊的有( )
①Ba(OH)2溶液②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液.
A . ③④⑤
B . ②③⑤
C . ①③④⑤
D . ②③④⑤
下列物质的制备与工业生产实际相符的是( )
A . N2  NO2
NO2  HNO3
B . MnO2
HNO3
B . MnO2  Cl2
Cl2  漂白粉
C . 黄铁矿
漂白粉
C . 黄铁矿 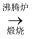 SO2
SO2 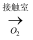 SO3
SO3 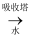 稀硫酸
D . 铝土矿
稀硫酸
D . 铝土矿 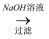 NaAlO2溶液
NaAlO2溶液  Al(OH)3
Al(OH)3  Al2O3
Al2O3  Al
Al
 NO2
NO2  HNO3
B . MnO2
HNO3
B . MnO2  Cl2
Cl2 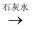 漂白粉
C . 黄铁矿
漂白粉
C . 黄铁矿 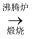 SO2
SO2 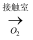 SO3
SO3 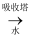 稀硫酸
D . 铝土矿
稀硫酸
D . 铝土矿  NaAlO2溶液
NaAlO2溶液  Al(OH)3
Al(OH)3  Al2O3
Al2O3  Al
Al
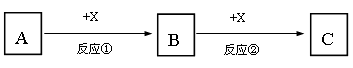
A,B,C,X均为中学常见的纯净物,它们之间有如下转化关系(反应条件及副产物已略去)。
-
(1) 若A,B,C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为。
-
(2) 若A,B,C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为。
-
(3) 若A,B,C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为。
-
(4) 若A为单质Fe,X为稀硝酸,则反应②的离子方程式为;若向B的溶液中加入氢氧化钠溶液,现象为,对应的化学方程式为。
-
(5) 若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为。
下列说法中正确的是( )
A . 食品袋中常放生石灰,能起到抗氧化剂的作用
B . NaHCO3固体可以做干粉灭火剂,金属钠着火可以用其来灭火
C . 硫酸可用于化肥、医药、农药的生产,金属矿石的处理
D . 用于电气工业的纯铜可由黄铜矿冶炼直接得到
用图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )

A . 上下移动①中铜丝可控制SO2的产生与停止
B . ②中选用品红溶液验证SO2的生成
C . ③中选用NaOH溶液吸收多余的SO2
D . 为确认有CuSO4生成,向①中加水,观察颜色
化学与生产、生活密切相关。下列说法错误的是( )
A . 新能源汽车的推广和使用,有助于减少光化学烟雾的产生
B . 燃煤中加入适量石灰石,可以减少SO2的排放
C . 加强城市生活污水脱氮脱磷处理,遏制水体富营养化
D . Na2O2和Na2O皆可用作呼吸面具中的供氧剂
通入SO2能引起下列溶液的颜色变化,其中SO2的作用和SO2使溴水褪色相同的是( )
A . 品红褪色
B . NaOH酚酞溶液褪色
C . 石蕊试液变红
D . 酸性KMnO4溶液褪色
下列图示箭头方向表示与某种常见试剂在通常条件下发生转化,其中6步转化均能一步实现的一组物质是( )
| 选项 | W | X | Y | Z | |
| A | | | | | |
| B | | | | | |
| C | | | | | |
| D | S | | | |
A . A
B . B
C . C
D . D
SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,某学习小组为了探究二氧化硫的某些性质,进行了如下实验。
-
(1) I.如图所示,使用试剂和装置探究二氧化硫的还原性:
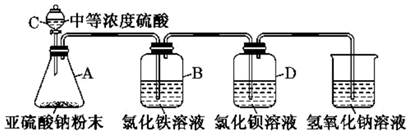
A中反应的离子方程式为。装置C中硫酸质量分数大约为70%,用此浓度硫酸的理由是。
-
(2) 装置B中溶液的现象为。
-
(3) 学生甲预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。学生乙经过查阅资料发现少量白色沉淀可能是硫酸钡,因为装置或溶液中少量的氧气参与了氧化反应,请写出装置D中反应的化学方程式:。
-
(4) II.学习小组又设计了如下装置,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。(所配制的溶液均使用无氧蒸馏水)

加入碳酸钠粉末的目的是。
-
(5) 当时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
-
(6) 结合实验目的分析装置中选用澄清石灰水而不用氧化钠溶液的原因是。
下列说法不正确的是( )
A .  能导致“光化学烟雾”的形成
B . 浓硝酸可用铝槽车运输
C . 石灰石在高温下可用于消除燃煤烟气中的
能导致“光化学烟雾”的形成
B . 浓硝酸可用铝槽车运输
C . 石灰石在高温下可用于消除燃煤烟气中的  D . 氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却
D . 氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却
 能导致“光化学烟雾”的形成
B . 浓硝酸可用铝槽车运输
C . 石灰石在高温下可用于消除燃煤烟气中的
能导致“光化学烟雾”的形成
B . 浓硝酸可用铝槽车运输
C . 石灰石在高温下可用于消除燃煤烟气中的  D . 氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却
D . 氮气化学性质稳定,可将炽热的镁粉放在氮气中冷却
化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:
-
(1) 已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和ClO-的物质的量分数(α)随pH变化的关系如图所示。用氯气处理饮用水时,pH=7.5与pH=6,杀菌效果较强的是(填数字)。用NaOH调节该溶液pH,写出由氯气生成ClO-的离子方程式是。

-
(2) “84消海液”的有效成分是NaClO,往“84消毒液”中加入少量醋酸可增强效果,该反应的离子方程式是,若消毒液在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是。
-
(3) ClO2和NaClO2均为重要的杀菌消毒剂。将ClO2气体通入到NaOH和H2O2混合溶液中,可制备NaClO2。写出由ClO2制备NaClO2的离子方程式。
-
(4) ClO2为淡棕黄色气体,易溶于水生成HClO。可由
 与适量潮湿的Na2CO3反应来制得ClO2 , 同时产生一种无色无味气体,写出该反应的化学方程式。将制得的ClO2通入水中生成HClO溶液,设计简单实验证明HClO具有永久漂白性:。(写出操作过程、现象和结论)
与适量潮湿的Na2CO3反应来制得ClO2 , 同时产生一种无色无味气体,写出该反应的化学方程式。将制得的ClO2通入水中生成HClO溶液,设计简单实验证明HClO具有永久漂白性:。(写出操作过程、现象和结论)
下列物质之间的转化不能一步实现的是( )
A . Na→NaOH
B . S→SO3
C . Fe→FeCl3
D . Cl2→HCl
下列说法错误的是( )
A . 碳酸氢钠固体受热分解产物均为含氧化合物
B . 氯化铝溶液中滴入过量氨水可得到白色沉淀
C . 加热条件下铜能与浓硫酸发生反应
D . 二氧化硫漂白纸浆是利用了其氧化性
某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:
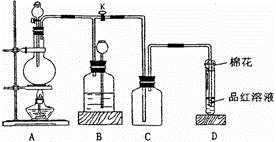
-
(1) 装置A中发生的化学反应方程式为;此反应表明浓硫酸具有(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
-
(2) 装置D中试管口放置的棉花中浸入溶液,其作用是。
-
(3) 装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
-
(4) 实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
某些物质之间可以在一定条件下进行如下转化,下列说法正确的是( )

A . 若X是金属单质,则该金属元素一定位于周期表的d区或 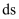 区
B . 若X是乙醇、Y是乙醛,则Z一定是乙酸
C . 若X是
区
B . 若X是乙醇、Y是乙醛,则Z一定是乙酸
C . 若X是  ,则Y既可以是黄色固体,也可以是有漂白性的无色气体
D . 若X是
,则Y既可以是黄色固体,也可以是有漂白性的无色气体
D . 若X是  ,则Z可以是无色气体
,则Z可以是无色气体 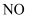
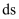 区
B . 若X是乙醇、Y是乙醛,则Z一定是乙酸
C . 若X是
区
B . 若X是乙醇、Y是乙醛,则Z一定是乙酸
C . 若X是  ,则Y既可以是黄色固体,也可以是有漂白性的无色气体
D . 若X是
,则Y既可以是黄色固体,也可以是有漂白性的无色气体
D . 若X是  ,则Z可以是无色气体
,则Z可以是无色气体 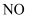
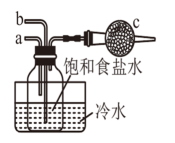
下列做法或实验(图中部分夹持略),不能达到目的的是( )
防止铁管道被腐蚀 | 检验产生的SO2 | 模拟侯氏制碱法:a先通入NH3 , b中再通入CO2 , c放蘸有稀硫酸的脱脂棉 | 测量气体体积时,减少误差 |
|
|
|
|
A | B | C | D |
A . A
B . B
C . C
D . D
最近更新