第六章 化学反应与能量 知识点题库
 N2O4(g) △H<0,达到平衡后,下列说法错误的是( )
N2O4(g) △H<0,达到平衡后,下列说法错误的是( )
-
(1) 书写下列反应的离子方程式
①NaOH溶液和HCl溶液:;
②NaCl溶液和AgNO3溶液:;
③Na2CO3溶液和氢氧化钙溶液: 。
-
(2) 在2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O反应中:
①被氧化,氧化剂,氧化产物是; 还原剂,还原产物是。
②用双线桥法表示该反应的电子转移情况
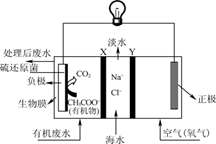

 乙烯,同时生成
乙烯,同时生成  C . 左侧电极反应式为
C . 左侧电极反应式为  D .
D .  移动方向为从右到左
移动方向为从右到左
-
(1) 目前我省居民使用的主要能源有①煤;②石油;③风能;④天然气;⑤电能等,其中属于可再生能源的是(填序号),请再举出我省居民生活中的一种可再生能源。
-
(2) 甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的。已知25℃、101kPa时,1mol甲烷完全燃烧生成CO2和液态水时放出896 kJ热量,该反应热化学反应方程式为:。
-
(3) 一定温度下,在偏铝酸亚铜(CuAlO2)的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,该反应方程式:,其优点是(请写出一条)。
-
(4) 甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①b极电极反应式为。
②若燃料电池消耗的空气在标准状况下的体积是5.6 L(假设空气中O2体积分数为20%),则理论上消耗甲烷mol。

① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低
② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1
③在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系c(NH4+)+2c(H+) =2c(OH-)+ c(NH3·H2O)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw则三者关系为:Ka·Kh=Kw
⑥ 反应A(g)  2B(g);若正反应的活化能为Ea kJ·mol-1 , 逆反应的活化能为Eb kJ·mol-1 , 则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是( )
2B(g);若正反应的活化能为Ea kJ·mol-1 , 逆反应的活化能为Eb kJ·mol-1 , 则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 往FeCl3溶液中加入少量铜粉 | 铜粉溶解 | 氧化性:Cu2+>Fe3+ |
| B | 向AgCl浊液中加入少量0.1mol/LKI溶液 | 白色沉淀颜色变黄 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中滴加几滴新制氯水,再滴加少量KSCN溶液 | 溶液变红色 | 某溶液中含有Fe2+ |
| D | 将稀H2SO4滴加到饱和Na2SO3溶液中,将产生的气体通入KMnO4溶液 | 紫色溶液褪去 | 产生的气体具有漂白性 |
 ,B电极是
,B电极是  。通过光解水,可由
。通过光解水,可由  制得异丙醇。下列说法错误的是( )
制得异丙醇。下列说法错误的是( ) 
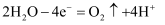 C . 转移18mol电子,一定生成60g异丙醇
D . A极选用高活性和高选择性的电化学催化剂能有效抑制析氢反应
C . 转移18mol电子,一定生成60g异丙醇
D . A极选用高活性和高选择性的电化学催化剂能有效抑制析氢反应
 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
-
(1) 在埋炭实验条件下,不同碳素材料的
 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下: ①


②


③


④


则

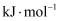 。
。 -
(2) 直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤


⑥


反应⑤、反应⑥中吉布斯自由能(ΔG)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线(填“Ⅰ”或“Ⅱ”),试分析氧化铝碳热还原氯化法炼铝的可行性:。
-
(3) 在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为  )中加入足量的碳和
)中加入足量的碳和  ,平衡时体系中气体体积分数与温度的关系如图2所示。
,平衡时体系中气体体积分数与温度的关系如图2所示。  ①650℃反应达到平衡时,容器体积为10L,则平衡时
①650℃反应达到平衡时,容器体积为10L,则平衡时  。
。②T℃时,若向平衡体系中再充入一定量
 的混合气体,则平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。
的混合气体,则平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数
 [用含
[用含  的代数式表示,气体分压
的代数式表示,气体分压  ]。
]。 -
(4) CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为。
 2HI(g),下列措施不能提高其反应速率的是( )
2HI(g),下列措施不能提高其反应速率的是( )


-
(1) 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-885 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH2=-2600 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ/mol
则2CH4(g)=C2H2(g)+3H2(g)ΔH=kJ/mol
-
(2) ①若用
 分别表示CH4、CH2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是(填标号)。
分别表示CH4、CH2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是(填标号)。 
②在恒容密闭容器中充入amol甲烷,测得单位时间内在固体催、化剂表面CH4的转化率[α(CH4)]与温度(t℃)的关系如图所示,t0℃后CH4的转化率突减的原因可能是。

-
(3) 甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(t/℃)的关系如图所示。

①T℃时,化学反应2CH4 (g)=C2H2(g)+3H2(g)的压强平衡常数K=Pa2。
②在某温度下,向VL恒容密闭容器中充入0.12mol CH4只发生反应2CH4(g)=C2H4(g)+2H2(g),达到平衡时,测得p(H2)=p(CH4)。CH4的平衡转化率为(结果保留两位有效数字)。
-
(4) 甲烷除裂解反应外还能发生水蒸汽重整反应,涉及以下反应方程式:
I.CH4(g)+H2O(g)→CO(g)+3H2(g) ΔH1=+206kJ·mol-1;
II.CO(g)+H2O(g)→CO2(g)+H2(g) ΔH2=-41kJ·mol-1;
在一体积可变的密闭容器中,加入一定量的CH4和H2O(g)发生水蒸汽重整反应。
①压强为P0kPa时,分别在加CaO和不加CaO时,平衡体系H2的物质的量随温度变化如图所示。温度低于700℃时,加入CaO可明显提高混合气中H2的量,原因是

②500℃时,反应相同时间后测得CH4的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(G)(填“>”“<”或“=”)c(E)。

(ⅰ)CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.3 kJ/mol
(ⅱ)CO2(g)+H2(g)  CO(g)+H2O(g) △H2=+41.1 kJ/mol
CO(g)+H2O(g) △H2=+41.1 kJ/mol
由CO也能直接加氢合成甲醇:(iii) 2H2(g)+CO(g)  CH3OH(g) △H
CH3OH(g) △H
-
(1) △H =kJ/mol。
-
(2) 反应(ⅱ) CO2(g)+H2(g)
 CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。
CO(g)+H2O(g)的正、逆反应平衡常数随温度变化曲线如图所示。 
下列分析正确的是_______。
A . 曲线甲为K(逆),曲线乙为K(正) B . a点时,一定有v正=v逆 C . c点时,x=0.5 -
(3) 催化剂M、N对CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~
CH3OH(g)+H2O(g)反应进程的能量影响如下图(a)所示,两种催化剂对应的1nk~  关系如下图(b)所示(已知;lnk=-
关系如下图(b)所示(已知;lnk=-  +C,其中Ea为活化能,k为速率常数,R和C为常数)。
+C,其中Ea为活化能,k为速率常数,R和C为常数)。 
①使用催化剂M时,逆反应的活化能为kJ/mol。
②催化剂N对应曲线是图(b)中的(填“Ⅰ”或“Ⅱ”)
-
(4) 为进一步研究CO2与H2反应制CH3OH的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内,测得甲醇生成速率与温度的关系如图所示。

①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是。
②结合研究目的,参照图中三条曲线,你可得出的结论是(写一条)。
-
(5) 恒温下,在压强恒定为P的装置中,按n(CO2):n(H2)=1:3加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若CO2转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的平衡常数计算式:Kp=(不必化简)。(已知:
CH3OH(g)+H2O(g)的平衡常数计算式:Kp=(不必化简)。(已知:  的选择性x=
的选择性x=  ×100%;Kp为用分压代替浓度的平衡常数。)
×100%;Kp为用分压代替浓度的平衡常数。)
-
(1) H2O分子用电子式表示为。该反应中每生成0.5 mol甲醇,转移电子的物质的量是mol。
-
(2) 一定条件下,该反应过程中的能量变化情况如图所示,图中E2-E1 =kJ·mol−1。

-
(3) T1℃下,向一容积为3 L的恒容密闭容器中加入一定量的CO2和H2 , 在催化剂存在时发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:
CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:t / min
n(CO2) / mol
n(H2) / mol
n(CH3OH) / mol
n(H2O) / mol
0
2.00
6.00
0
0
t1
1.65
a
0.35
0.35
t2
b
3.60
0.80
0.80
t3
b
3.60
0.80
0.80
①0 ~ t1 min内,用H2浓度变化表示该反应的化学反应速率为mol·L−1·min−1。
②下列有关上述反应的说法正确的是(填序号)
A.CH3OH中的化学键是共价键
B.消耗3 mol H2(g)的同时生成1 mol H2O(g),此时该反应达到化学平衡
C.0 ~ t1 min内反应放出的热小于t1~ t2 min内放出的热
-
(4) 甲醇(CH3OH)燃料电池的电极采用膜电极,该电极由催化剂层和质子交换膜构成,其中质子交换膜能传导H+ , 同时作为隔膜防止两极的物质相互反应。该电池的工作原理如图:

①该电池的负极是。(填“电极a”或“电极b”)
②工作时,电极b的电极反应式是。

下列关于活化历程的说法错误的是( )

 2Fe2O3+8Na2CrO4+8CO2
B . 浸取所得溶液中大量共存的离子有Na+、Al3+、AlO
2Fe2O3+8Na2CrO4+8CO2
B . 浸取所得溶液中大量共存的离子有Na+、Al3+、AlO 、CrO
、CrO 、CO
、CO C . 除杂时,加入稀硫酸,发生的反应为非氧化还原反应
D . 向Na2CrO4溶液加入硫酸酸化,溶液将由黄色变为橙色
C . 除杂时,加入稀硫酸,发生的反应为非氧化还原反应
D . 向Na2CrO4溶液加入硫酸酸化,溶液将由黄色变为橙色
 2NH3(g),2 min后测得生成0.06 mol NH3 , 则该段时间内用NH3来表示的化学反应速率为( )
2NH3(g),2 min后测得生成0.06 mol NH3 , 则该段时间内用NH3来表示的化学反应速率为( )

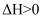 。
。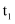 温度时,向密闭容器中通入X,部分实验数据见下表:
温度时,向密闭容器中通入X,部分实验数据见下表:时间/s | 0 | 50 | 100 | 150 |
| 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中错误的是( )
 B .
B . 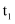 温度下的平衡常数
温度下的平衡常数 , 平衡时X的转化率为50%
C .
, 平衡时X的转化率为50%
C . 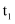 温度下的平衡常数为
温度下的平衡常数为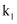 ,
,  温度下的平衡常数为
温度下的平衡常数为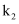 , 若
, 若 , 则
, 则 D .
D . 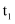 时,
时, 的平衡常数为
的平衡常数为




