第二节 化学反应的速率与限度 知识点题库
在密闭容中发生下列反应aA(气)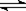 cC(气)+dD(气),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(气)+dD(气),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
某小组同学欲探究NH3催化氧化反应,按下图装置进行实验.
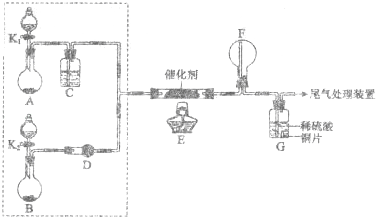
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)NH3催化氧化的化学方程式是 ;
(2)装置B中产生气体的原因有(结合化学用语解释) ;
(3)甲乙两同学分别按上述装置进行实验.一段时间后,装置G中溶液都变成蓝色.
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是 ;
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式) ;
③用离子方程式解释装置G中溶液变成蓝色的原因: ;
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进.
①甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”) 装置A中的产气量,或(填“增加”或“减少”) 装置B中的产气量.
②乙认为可在装置E、F间增加一个装置,该装置可以是(填序号)
选项 | 规律 | 结论 |
A | 较强酸可以制取较弱酸 | 用亚硫酸溶液无法制取硫酸溶液 |
B | 升高温度,反应速率越快 | 常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
C | 金属越活泼,其阳离子氧化性越弱 | Fe3+的氧化性弱于Cu2+ |
D | Ksp小的沉淀易向Ksp更小的沉淀转化 | CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
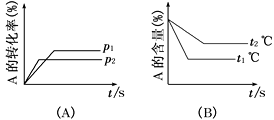
-
(1) 压强p1比p2(填“大”、“小”)。
-
(2) (a+b)比(c+d)(填“大”、“小”)。
-
(3) 温度t1℃比t2℃(填“高”、“低”)。
-
(4) Q值是(填“正”、“负”)。
 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
-
(1) 以NiBr2为催化剂,在一定条件下发生以下反应
NiBr2(l)+CO(g)
 Br2NiCO(l) △H1=+165.4kJ/mol;
Br2NiCO(l) △H1=+165.4kJ/mol;Br2NiCO(l)+CH3CH2OH(l)+C2H2(g)
 NiBr2(l)+CH2=CHCOOC2H5(l) △H2=-385.6 kJ/mol;
NiBr2(l)+CH2=CHCOOC2H5(l) △H2=-385.6 kJ/mol;Br2NiCO(l)+3CO(g)
 Ni(CO)4(l)+ Br2(l) △H3=-451.7kJ/mol;
Ni(CO)4(l)+ Br2(l) △H3=-451.7kJ/mol;请写出乙炔羰基化法合成EA的热化学方程式因存在副反应,为提高EA的产率,应适当(填“增大”或“减小”)一氧化碳与乙炔的物质的量之比。
-
(2) 在一定条件下,向反应釜中加入的乙醇1.55mol、乙炔0.52mol、一氧化碳和催化剂进行反应,反应30min时,乙炔的转化率为59%,前30min乙炔的平均反应速率为mol/min。欲使前期反应速率提高,应采取的措施是。
-
(3) 乙炔羰基化反应达到平衡时总压强为5.5Mp,乙炔的平衡转化率与温度的关系如图所示[其中n(乙炔):n(CO):(乙醇)=1:1:1)]
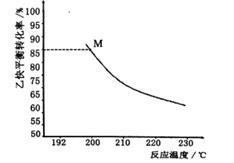
忽略副反应的影响计算该反应在图中M点的平衡常数Kp=__(用平衡分压代替平衡浓度计算,P分压=P总压×气体物质的量分数)。
-
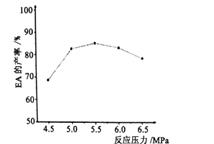
(4) 下图为EA产率与反应压强的关系,图中曲线呈现先升高后降低的变化趋势,其升高的原因是
-
(5) 可利用铁作电极、过硫酸铵[(NH4)2S2O8]作为引发剂,通过电化学方法利用EA制备聚丙烯酸乙酯。电解时,铁电极产生的Fe2+与溶液中的S2O82-发生氧化还原反应生成自由基SO4-·,引发聚合,形成聚丙烯酸乙酯。写出产生自由基SO4-·的离子方程式
-
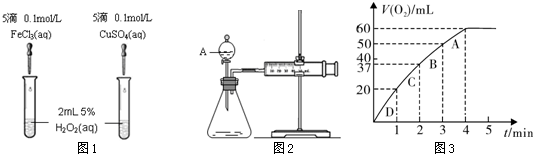
(1) 定性分析:如图1可通过观察,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是。
-
(2) 定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是。
-
(3) 加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式。
②实验时放出气体的总体积是mL。
③A,B,C,D各点反应速率快慢的顺序为:>>>。
解释反应速率变化的原因。
④H2O2的初始物质的量浓度是(请保留两位有效数字)。
①增大反应物的浓度②升高温度③增大压强④加入催化剂
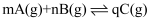 平衡的影响图像如图所示,下列判断正确的是( )
平衡的影响图像如图所示,下列判断正确的是( ) 
 ,则该反应中
,则该反应中  C . 图中,点
C . 图中,点  和点
和点  的反应速率大小为
的反应速率大小为  D . 当反应达到平衡时,只加入催化剂,
D . 当反应达到平衡时,只加入催化剂,  的百分含量将发生变化
的百分含量将发生变化
 。不同情况下反应过程的能量变化如图。下列结论正确的是( )
。不同情况下反应过程的能量变化如图。下列结论正确的是( ) 
 (g)和3mol
(g)和3mol  (g)混合后反应,放出Q kJ热量
B . 催化剂可以改变反应途径,缩短达到平衡的时间
C . 当生成的水为液态时,Q值减小
D . 催化剂不同,反应的热效应不同
(g)混合后反应,放出Q kJ热量
B . 催化剂可以改变反应途径,缩短达到平衡的时间
C . 当生成的水为液态时,Q值减小
D . 催化剂不同,反应的热效应不同
资料:
①RH—10Fe是常温下以溶剂萃取和溶胶凝胶法,利用Fe(NO3)3溶液和稻谷壳中提取的硅酸盐材料制得的Fe-Si催化剂。
②硅酸盐材料具有多孔状结构,热稳定性佳,可用作催化剂载体。

-
(1) Ⅰ.配位-沉淀法制备
 高效光催化剂
高效光催化剂 
已知:i.Ag3PO4难溶于水,可溶于硝酸;
ii.Ag3PO4沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
iii.银氨溶液中存在:

配制银氨溶液时的反应现象是。
-
(2) 加入
 溶液时,发生以下反应,请将离子方程式补充完整:
溶液时,发生以下反应,请将离子方程式补充完整: □
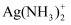 +□+□=□NH3+□+□
+□+□=□NH3+□+□ -
(3)
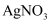 和
和 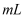 在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:。
在溶液中反应也可制得Ag3PO4固体,但制得的Ag3PO4固体光催化性能极差。从速率角度解释其原因:。
-
(4) Ⅱ.Ag3PO4光催化剂的使用和再生
已知:Ag3PO4晶体在光照条件下发挥催化作用时,首先引发反应。a.

Ag3PO4光催化CO2制备甲醇可实现“碳中和”,a的后续反应:
 ,
,  ,则由CO2制备甲醇的总反应的化学方程式为。
,则由CO2制备甲醇的总反应的化学方程式为。 -
(5) Ag3PO4光催化降解RhB(代表有机污染物),RhB被氧化成CO2和H2O。a的后续反应

注:Ag3PO4在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
用Ag3PO4依次降解三份相同的废水,测得3次降解过程中RhB的残留率(
 :即时浓度与起始浓度之比)随时间变化的曲线如图。
:即时浓度与起始浓度之比)随时间变化的曲线如图。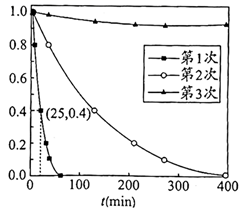
①下列说法正确的是(填字母序号)。
a.
 和
和  是降解RhB的重要氧化剂
是降解RhB的重要氧化剂b.第1次使用后Ag3PO4的光催化性能降低
c.该实验条件下,Ag3PO4使用两次即基本失效
②第1次光降解时,
 内的反应速率为
内的反应速率为  (废水中RhB初始浓度
(废水中RhB初始浓度  为
为  ,RhB的摩尔质量为
,RhB的摩尔质量为  )
)
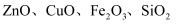 及MnO2等)回收金属铜并制取锌白(
及MnO2等)回收金属铜并制取锌白(  )的工艺流程如下:
)的工艺流程如下: 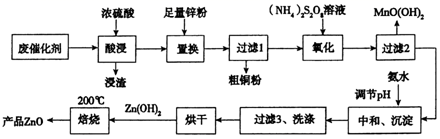
已知:
① 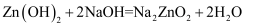
② 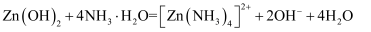
请回答下列问题:
-
(1) 为了加快废催化剂酸浸的速率,可以采取的措施是(任写一条)。
-
(2) 浸渣的主要成分是(填化学式,下同),粗铜粉中含有的杂质是。
-
(3) “酸浸”过程中生成
 ,同时还有氧气逸出,写出
,同时还有氧气逸出,写出  与浓
与浓 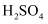 反应的化学方程式:。
反应的化学方程式:。
-
(4) “氧化”过程中
 被氧化的离子方程式为。
被氧化的离子方程式为。
-
(5) 加入氨水调节溶液
 时,要使
时,要使  沉淀完全,则应调节溶液
沉淀完全,则应调节溶液  的最小值为(结果保留两位小数)(已知:当
的最小值为(结果保留两位小数)(已知:当  时,认为
时,认为  沉淀完全;常温下
沉淀完全;常温下  ;
; 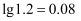 )。
)。
-
(6) 在加入氨水“中和、沉淀”的过程中,沉淀的析出率与溶液温度的关系如图所示:
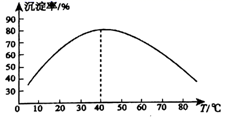
当溶液温度高于
 时,
时, 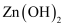 的沉淀率随着温度升高而降低的原因是。
的沉淀率随着温度升高而降低的原因是。

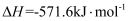 ;
; 
 。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是( )
。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是( ) 
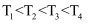 C . 图中投料比中的反应物X与Y分别指CO2与H2
D . 图中曲线最低温度、起始投料比为2时,H2平衡转化率为90%
C . 图中投料比中的反应物X与Y分别指CO2与H2
D . 图中曲线最低温度、起始投料比为2时,H2平衡转化率为90%
 CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。下列有关说法正确的是( )
CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。下列有关说法正确的是( )

 。如图所示,在恒容密闭容器中,反应温度为T1时,c(N2O4)和c(NO2)随t变化为曲线I、II,改变温度到T2 , c(NO2)随t变化为曲线III。下列判断正确的是( )
。如图所示,在恒容密闭容器中,反应温度为T1时,c(N2O4)和c(NO2)随t变化为曲线I、II,改变温度到T2 , c(NO2)随t变化为曲线III。下列判断正确的是( )




