第一节 反应热 知识点题库
已知氢气和氧气反应生成4.5g水蒸气,同时放出60.45kJ的热量,则下列热化学方程式正确的是( )
A . 2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
B . 2H2(g)+O2(g)=2H2O(l)△H=﹣483.6kJ/mol
C . 2H2(g)+O2(g)=2H2O(g)△H=﹣241.8kJ/mol
D . 2H2(g)+O2(g)=2H2O(l)△H=﹣241.8kJ/mol
键能是断裂1mol共价键所吸收的能量.已知H﹣H键能为436KJ/mol,H﹣N键能为391KJ/mol,根据化学方程式:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4KJ/mol,则N≡N键的键能是 KJ/mol.
-
(1) 在101 kPa时,足量H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为,表示H2燃烧热的热化学方程式为 。
-
(2) 1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为,表示其中和热的热化学方程式为。
关于下列各装置图的叙述中,错误的是( )

A . 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B . 装置②为原电池,总反应是:Fe +2Fe3+=3 Fe2+
C . 图③所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化
D . 图④所示曲线,表示该反应是放热反应
已知X+Y=M+N为吸热反应,对该反应的下列说法中正确的是( )
A . X的能量一定低于M的能量
B . Y的能量一定低于N的能量
C . X和Y的总能量一定低于M和N的总能量
D . 因该反应为吸热反应,故该反应一定要加热才可发生
下列有关中和反应的反应热的说法正确的是( )
A . 中和反应反应热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ·mol-1
B . 准确测量中和反应反应热的实验过程中,至少需测定温度4次
C . 环形玻璃搅拌棒材料若用铜代替,则测量出的中和反应反应热数值偏小
D . 若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和反应反应热数值更准确
六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:

-
(1) 这六种元素的氢化物中,最稳定的是.(写化学式);
-
(2) AF2的结构式为.
-
(3) 在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:.
-
(4) 工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式.该反应中被氧化的G与参与反应的G的质量之比.
-
(5) F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:.
下列说法正确的是( )
A . 需要加热才能发生的反应一定是吸热反应
B . 吸热反应的反应物的总能量之和大于生成物的总能量之和
C . Ba(OH)2·8H2O与NH4Cl 的反应是放热反应
D . 碳高温下与CO2反应是吸热反应
下列反应中生成物总能量高于反应物总能量的是( )
A . 铝粉与氧化铁粉末反应
B . 乙醇燃烧
C . 碳酸钙受热分解
D . 氧化钙溶于水
根据如下能量关系示意图,下列说法正确的是( )
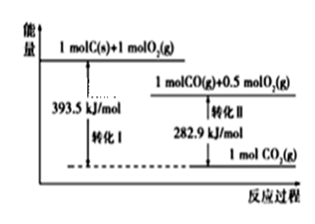
A . 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B . 反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量
C . 由C→CO的热化学方程式为:2C(s)+O2(g)=2CO(g) ΔH=-221.2 kJ·mol−1
D . 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol−1
某化学兴趣小组要完成中和热的测定。
-
(1) 实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是、。
-
(2) 实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
-
(3) 他们记录的实验数据如表:
实验用品
溶液温度
中和热
t1
t2
ΔH
①
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.3 ℃
②
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
-
(4) 若用KOH代替NaOH,对测定结果
(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。
下列说法中正确的是( )
A . 凡是放热反应都足自发的,吸热反应都处非自发的
B . 自发反应一定是熵增大,非自发反应一定是熵减小或不变
C . 熵增加且放热的反应一定是自发反应
D . 非自发反应在任何条件下都不能实观
下列说法错误的是( )
A . 通常情况(同温同压)下,金刚石比石墨稳定
B . 分解反应不一定都是吸热反应
C . 1mol CH3CH2CN与H2在一定条件下完全加成,常需2mol H2
D . 常温常压时,KOH与HCl两种稀溶液完全反应的热化学方程式是H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1
下列说法中正确的是( )
A . 焓变是指1 mol物质参加反应时的能量变化
B . 反应放热时,ΔH>0;反应吸热时,ΔH<0
C . 在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同
D . 在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓
甲醇是一种重要的可再生能源。
-
(1) 已知:2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=a kJ/mol;CO(g)+2H2(g)=CH3OH(g) ΔH=b kJ/mol;写出由CH4和O2制取CH3OH(g)的热化学方程式。
-
(2) 反应:CO(g)+2H2(g)
 CH3OH(g)的平衡常数K的表达式为。
CH3OH(g)的平衡常数K的表达式为。
-
(3) 图1是(2)中反应发生时,CO和CH3OH(g)的物质的量浓度随时间的变化曲线,从反应开始至达到平衡时,反应速率v(H2)=。

-
(4) 在一容积可变的密闭容器中充入10mol CO和20mol H2 , 发生(2)中反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图2所示。
①比较A、B两点压强大小:P(A)P(B)(填“>”、“<”或“=”)。
②比较KA、KB、KC的大小:。
-
(1)
 回收利用是科学研究的热点课题。已知几种物质的相对能量如下:
回收利用是科学研究的热点课题。已知几种物质的相对能量如下: 物质



相对能量/kJ/mol
-393.5
-110.5
-242
0
计算反应
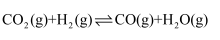 生成2molCO时(填“吸收”或“放出”)的热量是kJ。
生成2molCO时(填“吸收”或“放出”)的热量是kJ。 -
(2) 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆,甲醇燃料电池的工作原理如图所示(电池总反应为:
 )
) 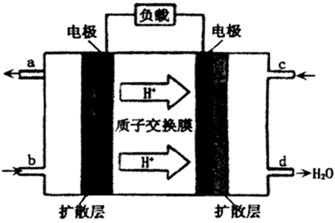
①该电池工作时,b口通入的物质为,c口通入的物质为。
②该电池负极的电极反应式为。
③工作一段时间后,当6.4g甲醇完全反应生成CO2时,电子转移的数目为。
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始  =Z,在恒压下,平衡时
=Z,在恒压下,平衡时  (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
 CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始  =Z,在恒压下,平衡时
=Z,在恒压下,平衡时 
A . 该反应的焓变△H<0
B . 图中Z的大小为a>3>b
C . 图中X点对应的平衡混合物中  >3
D . 温度不变时,图中X点对应的平衡在加压后
>3
D . 温度不变时,图中X点对应的平衡在加压后  (CH4)减小
(CH4)减小
 >3
D . 温度不变时,图中X点对应的平衡在加压后
>3
D . 温度不变时,图中X点对应的平衡在加压后
强酸与强碱的稀溶液发生中和反应:  。分别向
。分别向  的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硫酸,恰好完全反应的热效应分别为
的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硫酸,恰好完全反应的热效应分别为  ,它们的关系正确的是( )
,它们的关系正确的是( )
 。分别向
。分别向  的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硫酸,恰好完全反应的热效应分别为
的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硫酸,恰好完全反应的热效应分别为  ,它们的关系正确的是( )
,它们的关系正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
关于化学反应与能量的说法正确的是( )
A . 书写热化学方程式时,只要在化学方程式的右边写上能量变化值即可
B .  (浓)与
(浓)与  完全中和所放出的热量等于中和热的数值
C . 同温同压下,
完全中和所放出的热量等于中和热的数值
C . 同温同压下,  在光照和点燃条件下的
在光照和点燃条件下的  相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的
相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的 
 (浓)与
(浓)与  完全中和所放出的热量等于中和热的数值
C . 同温同压下,
完全中和所放出的热量等于中和热的数值
C . 同温同压下,  在光照和点燃条件下的
在光照和点燃条件下的  相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的
相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的 
下列说法正确的是( )
A . ΔH>0,ΔS>0的反应,在任何温度下都是非自发反应;
B . 因N2(g)+3H2(g)⇌2NH3(g) △H=-dkJ·mol-1 , 故在某容器中投入1molN2与3molH2充分反应后,放出热量小于dkJ
C . 一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)⇌2SO3(g) △H<0,当v正(SO2)=v正(SO3)时,说明该反应已达到平衡状态
D . 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
最近更新



