第一节 化学反应速率 知识点题库
①升高温度;②加入催化剂;③充入更多的H2;④扩大容器的体积;⑤容器容积不变,通入氖气.

 2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g) ΔH< 0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。 
-
(1) 表示N2浓度变化的曲线是 (填字母),25 min 时c (NH3)=。
-
(2) 0~25min内,用H2 浓度变化表示的化学反应速率是。
-
(3) 此温度下,上述反应的平衡常数K 的数值为。
-
(4) 若升高温度,则平衡向(填“正反应”或“逆反应”)方向移动;正反应速率 (填“增大”“减小”或“不变”,下同 ), 逆反应速率。
-
(1) 已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g) = 2H2O(g) ΔH= -b kJ/mol;H2O(g)=H2O(l) ΔH= -c kJ/mol。 则CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的ΔH=。
CH3OH(g)+H2O(g)的ΔH=。
-
(2) 某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2 , 发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如图中的曲线I,则前4分钟ν(CO2)=;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为;该温度下反应的化学平衡常数为。

-
(3) 在另一温度下发生合成甲醇的反应,如图关闭K,向A容器中充入1 mol CO2和4 mol H2 , 向B容器中充入1.2 mol CO2和4.8 mol H2 , 两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
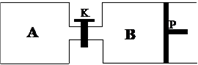
-
(4) 一定条件下甲醇可进一步氧化转化为甲酸。室温下,将a mol/L的甲酸与b mol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为。
-
(1) (一)工业上,在Cu2O/ZnO 作催化剂的条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g) △H
已知:CH3OH(l)=CH3OH(g) △H=+35.2kJ•mol-1 , 根据表:
物质
H2(g)
CO(g)
CH3OH(l)
燃烧热/kJ•mol-1
-285.8
-283.0
-726.5
反应CO(g)+2H2(g)⇌CH3OH(g) △H=kJ•mol-1
-
(2) 向2L恒容密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图1所示。在500℃恒压条件下,请在图1中画出反应体系中n(CH3OH)与时间(t)变化总趋势图。
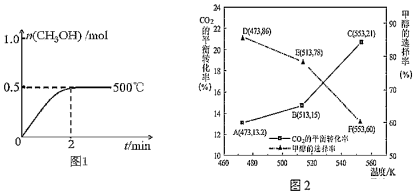
-
(3) (二)甲醇还可用CO2与H2在催化剂CZZA(普通铜基催化剂)作用下合成,相关反应如下:
反应ⅠCO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-49.2kJ•mol-1
反应ⅡCO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=41.2kJ•mol-1
以CZZA/rGO为催化剂,在一定条件下,将1mol CO2与3mol H2通入恒容密闭容器中进行反应I和反应II,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图2所示:
①在553K时,反应体系内CO的物质的量为 mol
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:
-
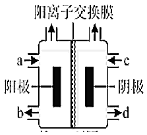
(4) (三)如图为氯碱工业的装置示意图,a端进入的物质为,工业上还可以利用该装置,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可制备四甲基氢氧化铵[(CH3)4NOH],则收集到(CH3)4NOH的区域是(填a、b、c或d),
 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
-
(1) 升高温度,B的转化率,v(正)。
-
(2) 使用催化剂,A的物质的量。
-
(3) 增大压强,v(逆),C的产率。
-
(4) 增大A的浓度,则B的转化率,A的转化率,C的物质的量。

 6FeO+O2↑
B . 过程Ⅱ的反应:2H2O=2H2↑+O2↑
C . 两个转化过程都发生了氧化还原反应
D . Fe3O4为整个过程的催化剂
6FeO+O2↑
B . 过程Ⅱ的反应:2H2O=2H2↑+O2↑
C . 两个转化过程都发生了氧化还原反应
D . Fe3O4为整个过程的催化剂
 CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:( )
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:( )
 CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
-
(1) 热再生氨电池的工作原理如图,其中电极材料均为铜片。
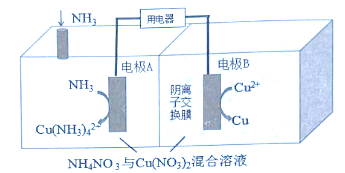
①电极A为 极,电极反应式为 。
②若有0.5mol电子在线路中经过,B电极变化的质量是 g。
-
(2) 氨基甲酸铵(NH2COONH4)是稀氨水喷雾捕集CO2过程的中间体。实验室分别在不同温度(T)下,将一定量纯净的氨基甲酸铵置于恒容密闭容器中,发生反应:
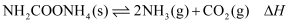
测得平衡时容器内气体总浓度与温度的关系如图。
①氨基甲酸铵分解反应
 0。(填“>”或“<”)
0。(填“>”或“<”)②P点:v(正) v(逆);(填“>”、“<”或“=”)
15℃时,该反应的平衡常数K= 。
-
(1) SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3•H2O(aq) =NH4HSO3(aq) △H1 = a kJ•mol-1;② NH3•H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJ•mol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJ•mol-1 , 则反应 2SO2(g) + 4NH3•H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = 。
-
(2) NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)
 N2(g) + CO2(g) △H=-34.0 kJ•mol-1 , 用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJ•mol-1 , 用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示: 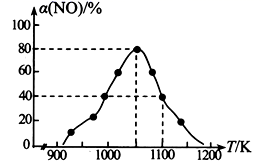
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是; 在1100K 时,CO2的体积分数为。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=(已知:气体分压=气体总压×体积分数)。
-
(3) 在高效催化剂的作用下用CH4还原NO2 , 也可消除氮氧化物的污染。在相同条件下,选用A,B,C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是(填字母标号)。
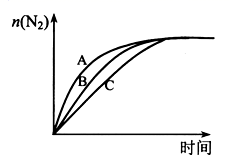
-
(4) 在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)
 N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJ•mol-1。实验测得,υ正=k正•c2(NO) •c2(CO) ,υ逆=k逆•c(N2) •c2(CO2) (k正、k逆为速率常数,只与温度有关)。 ①达到平衡后,仅升高温度,k正增大的倍数(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
 =(保留2位有效数字)。
=(保留2位有效数字)。
 溶液中加入适量
溶液中加入适量  溶液,不同时刻测得生成
溶液,不同时刻测得生成  的体积(已折算为标准状况)如下表所示:
的体积(已折算为标准状况)如下表所示: | t/min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++O2↑+2H+ , ②H2O2+2Fe2++2H+= 2H2O+2Fe3+。反应过程中的能量变化如图所示。下列说法错误的是( )

 的作用是增大过氧化氢的分解速率
B . 反应①是吸热反应、反应②是放热反应
C .
的作用是增大过氧化氢的分解速率
B . 反应①是吸热反应、反应②是放热反应
C .  内,平均反应速率:
内,平均反应速率:  D . 反应
D . 反应  的∆H=E1-E2<0
的∆H=E1-E2<0
-
(1) 研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=-49.6 kJ/mol
反应II:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4 kJ/mol
反应III:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
△H3=kJ/mol。
-
(2) 反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如表:
物质
CH3OCH3(g)
H2O(g)
CH3OH(g)
浓度/mol∙L-1
1.8
1.8
0.4
此时v正v逆(选填“>”“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=%。
-
(3) 在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。

①反应温度T1T2(选填“>”“<”或“=”),说明原因:;
②T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=;KA、KB、KC三者之间的大小关系为。
Ⅰ. 2H2(g)+O2(g)
 2H2O(g) ΔH1= -483.6 kJ·mol-1
2H2O(g) ΔH1= -483.6 kJ·mol-1
Ⅱ.N2(g)+O2(g)  2NO(g) ΔH2 = +180.5 kJ·mol-1
2NO(g) ΔH2 = +180.5 kJ·mol-1
Ⅲ.2H2(g)+ 2NO(g)  N2(g)+ 2H2O(g) ΔH3
N2(g)+ 2H2O(g) ΔH3
-
(1) 若已知反应III的正反应活化能为Ea kJ·mol-1 , 则逆反应活化能为kJ·mol -1(用含Ea的式子表示)。
-
(2) 在刚性容器中按投料比
 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间时,测得NO转化率与温度的关系如图1。
=1发生反应Ⅲ,不同催化剂条件下,反应相同时间时,测得NO转化率与温度的关系如图1。 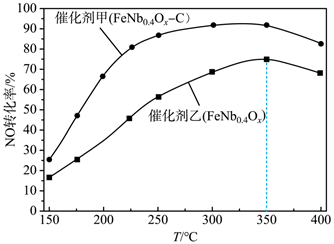
图1
①下列能够说明该反应已达到化学平衡状态的是
A.2v逆 (NO)=v 正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②使用催化剂乙、温度高于350℃时,NO 转化率降低的原因可能是。
③研究表明该反应v= kcm(H2)c2(NO),其中k为速率常数,与温度、活化能有关。T1℃的初始速率为v0 , 当H2转化率为50%时,反应速率为
 ,由此可知m=。设此时反应的活化能为Ea',不同温度T1、T2条件下对应的速率常数分别为k1、k2 , 存在关系:
,由此可知m=。设此时反应的活化能为Ea',不同温度T1、T2条件下对应的速率常数分别为k1、k2 , 存在关系:  (R为常数)。据此推测:活化能越大,升高温度,速率常数增大倍数。 (填“越大”“越小”或“不变”)
(R为常数)。据此推测:活化能越大,升高温度,速率常数增大倍数。 (填“越大”“越小”或“不变”) -
(3) 工业上常利用反应N2(g)+ 3H2(g)
 2NH3(g) ΔH<0合成氨气,在30 MPa、不同物质的量分数(75%的H2和25%的N2; 67.5%的 H2、22.5%的 N2和10%的惰性气体)条件下进行实验,测得平衡时,NH3体积分数与温度的关系如图2。
2NH3(g) ΔH<0合成氨气,在30 MPa、不同物质的量分数(75%的H2和25%的N2; 67.5%的 H2、22.5%的 N2和10%的惰性气体)条件下进行实验,测得平衡时,NH3体积分数与温度的关系如图2。 
图2
①物质的量分数为: 75%的H2和25%的N2所对应的曲线是。 (填“a”或“b”)
②M点时,N2的转化率为;该 反应的压强平衡常数Kp= (MPa)-2(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。
-
(1) 用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)
 HNO3(aq)+HNO2(aq)△H=-116.1kJ·mol-1
HNO3(aq)+HNO2(aq)△H=-116.1kJ·mol-13HNO2(aq)
 HNO3(aq)+2NO(g)+H2O(l)△H=+75.9kJ·mol-1
HNO3(aq)+2NO(g)+H2O(l)△H=+75.9kJ·mol-1反应3NO2(g)+H2O(l)
 2HNO3(aq)+NO(g)的△H=kJ·mol-1
2HNO3(aq)+NO(g)的△H=kJ·mol-1 -
(2) 用CO还原N2O的反应为:CO(g)+N2O(g)
 N2(g)+CO2(g),其能量变化如图甲所示:
N2(g)+CO2(g),其能量变化如图甲所示:

①投料比一定时,要提高N2O平衡转化率,可采取的措施是。
②反应达到平衡前,在同温同压条件下的相同时间段内,N2O的转化率在使用催化剂2时比使用催化剂1要高,原因是。
③在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入1molN2O、4molCO和相同催化剂,发生上述反应。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。

Ⅰ.曲线b中,从反应开始到M点处,用N2O表示的反应速率为mol/(L·s)。
Ⅱ.容器B中N2O的转化率随时间的变化关系是图乙中的(填“a”或“b”)曲线。
-
(3) 活性炭还原NO2的反应为2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1molNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中NO2的转化率最高的是(填“A”、“B”或“C”)点,理由是。
②C点时该反应的压强平衡常数Kp=MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。



