第三章 水溶液中的离子反应与平衡 知识点题库
-
(1) 已知:FeO(s)+CO(g)⇌FeO(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
T(K)
938
1100
K
0.68
0.40
①该反应平衡常数的表达式是.
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质
量(填“增大”、“减小”或“不变”)曰该反应正反应是反应(填“吸热”或“放热”).
-
(2) 常温下,下列溶液的浓度均为0.1mol•L﹣1 , 测得溶液pH值如下表:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.8
9.7
11.6
10.3
11.1
11.3
①由表中数据分析,上述溶质中的阴离子水解程度最小的是(填离子符号).
②由表中数据分析,0.01mol•L﹣1的下列溶液,酸性最弱的是(填编号).
A、H2CO3 B、HClO C、C6H5OH D、CH3COOH
③向氯水中加入少量的碳酸钠,可以增加氯水中HClO的浓度.为什么?.(请结合化学反应简要说明)
(用离子方程式表示);微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是,产生该气体的原因是,
总的离子反应方程式为。
 、
、  的值均增大
的值均增大
-
(1) 常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中c(H+)/c(OH-)=。
-
(2) 某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=。该温度(填“高于”或“低于”)25 ℃。
-
(3) 常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2 , 则c1/c2=。
-
(4) 常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=。
若所得混合溶液pH=12,则a∶b=。
-
(5) 在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=。
-
(1) ① NH3 ②SO3 ③ Cl2 ④ BaSO4 ⑤酒精⑥ CH3COONH4 ⑦HClO⑧Cu,以上物质中 属于非电解质的是,属于强电解质的是(填入编号)
-
(2) 已知醋酸和盐酸是极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ 。
①下列方法中,可以使 0.1mol/CH3COOH的电离程度增大的是。
a. 加入少量 0.1mol/L的稀盐酸 b. 加入少量 0.1mol/LCH3COOHc. 加水稀释至 0.01mol/L d. 加入少量冰醋酸e. 加入少量醋酸钠固体 f. 加入少量 0.1mol/L的NaOH溶液
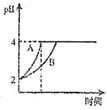
②常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1 , 醋酸溶液中加入的Zn粒质量为m2 , 则m1m2(填“<”、“=”、“>”)。
-
(1) 在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈性,溶液中c(Na+)c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈性,溶液中c(Na+)c(CH3COO-)(填“>”“=”或“<”);
-
(2) 下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为。
-
(3) CuSO4的水溶液呈酸性的原因是(用离子方程式表示):;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
-
(4) 在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有,其浓度由大到小的顺序为,氨水的浓度a0.01 mol·L-1(填“>”、“ <”或“=”)。
-
(5) 已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20 , 则常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1 , 如要生成Cu(OH)2沉淀,应调整溶液的pH最小为。
-
(6) 某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


①酸浸后加入H2O2的目的是,调pH的最适宜范围为。
②调pH过程中加入的试剂最好是。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
③煮沸CuSO4溶液的原因是;向CuSO4溶液中加入一定量的NaCl、Na2SO3 , 可以生成白色的CuCl沉淀,反应的化学方程式。


 )+2c(
)+2c(  )=c(Na+)
C . 点m到p的溶液中:水的电离程度逐渐减小
D . 点p所示溶液中:c(Na+)>c(
)=c(Na+)
C . 点m到p的溶液中:水的电离程度逐渐减小
D . 点p所示溶液中:c(Na+)>c(  )>c(H2C2O4)>c(
)>c(H2C2O4)>c(  )
)
 、
、  、
、  、
、 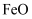 、
、  )为原料提取铍,具体流程如下:
)为原料提取铍,具体流程如下: 
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/g | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
回答下列问题:
-
(1) 流程中“系列操作”为。
-
(2) 将“中和液”沉淀时,调节溶液的
 不能过大或过小。
不能过大或过小。  过大时发生反应的离子方程式为。
过大时发生反应的离子方程式为。
-
(3) 已知
 ,
,  。若
。若  浓度为0.40
浓度为0.40  的中和液开始沉淀时,溶液中
的中和液开始沉淀时,溶液中 
 。
。
-
(4) 若在实验室洗涤粗
 ,操作为;洗涤时加入
,操作为;洗涤时加入  溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为。
溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为。
-
(5) 氧化铍转化为氯化铍的化学方程式为。
-
(6)
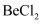 的电子式为;电解时须加入氯化钠的作用是。
的电子式为;电解时须加入氯化钠的作用是。

 2SO3中各成分的物质的量浓度变化,t2时刻改变的条件是缩小容器的体积
C . 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的CH3COOH溶液和一元酸HX溶液,则该温度下HX的电离平衡常数大于CH3COOH
D . 图丁表示用0.1000mol·L-1HCl溶液滴定0.1000mol·L-1NaOH溶液
2SO3中各成分的物质的量浓度变化,t2时刻改变的条件是缩小容器的体积
C . 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的CH3COOH溶液和一元酸HX溶液,则该温度下HX的电离平衡常数大于CH3COOH
D . 图丁表示用0.1000mol·L-1HCl溶液滴定0.1000mol·L-1NaOH溶液
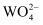 (aq)+Ca(OH)2(s)
(aq)+Ca(OH)2(s)  CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
-
(1) 如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。
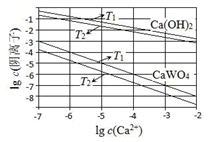
①计算T1时,Ksp(CaWO4)=。
②T1T2(填“>”“=”或“<”)。
-
(2) 反应Ⅰ的平衡常数K理论值如表:
温度/℃
25
50
90
100
K
79.96
208.06
222.88
258.05
①该反应平衡常数K的表达式为。
②该反应的ΔH0(“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2 , 反应达到平衡后
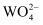 的沉淀率为60%,此时
的沉淀率为60%,此时 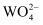 的平衡浓度为mol·L-1 , 实验测得的平衡常数为(保留小数点后两位)。
的平衡浓度为mol·L-1 , 实验测得的平衡常数为(保留小数点后两位)。 -
(3) 制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是。
选项 | 劳动项目 | 化学知识 |
A | 为保护地下钢管不被腐蚀,将钢管与直流电源负极相连 | 采用了牺牲阳极法进行防护 |
B | 使用纯碱溶液去油污 |
|
C | 石灰石可减少煤燃烧的 | 高温下石灰石和空气可将 |
D | 常用石墨作化学电池、电解池的电极 | 石墨的化学性质稳定且导电性好 |
|
|
|
|
A.测定次氯酸钠溶液的 | B.稳定性:石墨>金刚石 | C.测定氢氧化钠溶液的浓度 | D.实验室用浓盐酸与二氧化锰反应制取氯气 |
 溶液中滴加
溶液中滴加 溶液,测得混合溶液的
溶液,测得混合溶液的 与离子浓度变化的关系如图所示,下列说法错误的是( )
与离子浓度变化的关系如图所示,下列说法错误的是( )
 B . 交点a的溶液中:
B . 交点a的溶液中: C . m表示
C . m表示 与
与 的变化关系
D . 等浓度等体积的
的变化关系
D . 等浓度等体积的 溶液与
溶液与 溶液混合,所得溶液呈碱性
溶液混合,所得溶液呈碱性
 水解使溶液显碱性
水解使溶液显碱性 排放
排放