第дёҖиҠӮ з”өзҰ»е№іиЎЎ зҹҘиҜҶзӮ№йўҳеә“
в‘ йҶӢй…ёй’ жә¶ж¶Ізҡ„pH еӨ§дәҺ7
в‘Ўеёёжё©ж—¶пјҢ0.1mol/Lд№ҷй…ёжә¶ж¶Ізҡ„pHзәҰдёә3
в‘ўд№ҷй…ёиғҪе’Ңзўій…ёй’ҷеҸҚеә”ж”ҫеҮәCO2
в‘Ј10mL 1mol/Lд№ҷй…ёжә¶ж¶ІдёҺ10mL 1mol/Lзҡ„NaOHжә¶ж¶ІжҒ°еҘҪе®Ңе…ЁеҸҚеә”
в‘ӨеҗҢpHзҡ„зӣҗй…ёе’Ңд№ҷй…ёеҲҶеҲ«дёҺи¶ійҮҸй“ҒзүҮеҸҚеә”пјҢд№ҷй…ёдә§з”ҹH2еӨҡ
в‘ҘpH=1зҡ„йҶӢй…ёжә¶ж¶Із”Ёж°ҙзЁҖйҮҠ1000еҖҚеҗҺпјҢpHпјң4пјҺ
й…ёжҲ–зўұ | з”өзҰ»еёёж•°пјҲKaжҲ–Kbпјү |
CH3COOH | 1.8Г—10п№Ј5 |
HNO2 | 4.6Г—10п№Ј4 |
HCN | 5Г—10п№Ј10 |
HClO | 3Г—10п№Ј8 |
NH3вҖўH2O | 1.8Г—10п№Ј5 |
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүдёҠиҝ°еӣӣз§Қй…ёдёӯпјҢй…ёжҖ§жңҖејұзҡ„жҳҜ пјҲз”ЁеҢ–еӯҰејҸиЎЁзӨәпјүпјҺдёӢеҲ—иғҪдҪҝйҶӢй…ёжә¶ж¶ІдёӯCH3COOHзҡ„з”өзҰ»зЁӢеәҰеўһеӨ§пјҢиҖҢз”өзҰ»е№іиЎЎеёёж•°дёҚеҸҳзҡ„ж“ҚдҪңжҳҜ гҖҖпјҲеЎ«еәҸеҸ·пјүпјҺ
AпјҺеҚҮй«ҳжё©еәҰ BпјҺеҠ ж°ҙзЁҖйҮҠ CпјҺеҠ е°‘йҮҸзҡ„CH3COONaеӣәдҪ“ DпјҺеҠ е°‘йҮҸеҶ°йҶӢй…ё
пјҲ2пјүCH3COONH4зҡ„ж°ҙжә¶ж¶Іе‘Ҳ пјҲйҖүеЎ«вҖңй…ёжҖ§вҖқвҖңдёӯжҖ§вҖқжҲ–вҖңзўұжҖ§вҖқпјүпјҢзҗҶз”ұжҳҜпјҡ пјҢжә¶ж¶Ідёӯеҗ„зҰ»еӯҗжө“еәҰеӨ§е°Ҹзҡ„е…ізі»жҳҜгҖҖ пјҺ
ејұй…ёеҢ–еӯҰејҸ | CH3COOH | HCN | H2CO3 |
з”өзҰ»е№іиЎЎеёёж•°пјҲ25в„ғпјү | 1.8Г—10п№Ј5 | 4.9Г—10п№Ј10 | K1=4.3Г—10п№Ј7 K2=5.6Г—10п№Ј11 |
еҲҷдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү

-
пјҲ1пјү aгҖҒbгҖҒcдёүзӮ№еӨ„пјҢжә¶ж¶Ізҡ„cпјҲH+пјүз”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёә
-
пјҲ2пјү aгҖҒbгҖҒcдёүзӮ№еӨ„пјҢз”өзҰ»зЁӢеәҰжңҖеӨ§зҡ„жҳҜ
-
пјҲ3пјү иЎЁжҳҜеҮ з§Қеёёи§Ғејұй…ёзҡ„з”өзҰ»е№іиЎЎеёёж•°пјҲ25в„ғпјүпјҡ
й…ё
з”өзҰ»ж–№зЁӢејҸ
з”өзҰ»е№іиЎЎеёёж•°K
CH3COOH
CH3COOHвҮҢCH3COOп№Ј+H
K=1.76Г—10п№Ј5
H2CO3
H2CO3вҮҢH++HCO3п№ЈH2CO3п№ЈвҮҢH++HCO32п№Ј
K1=4.31Г—10п№Ј7K2=5.61Г—10п№Ј11
HClO
HClOвҮҢH++ClOп№Ј
K=3.0Г—10п№Ј8
CH3COOHгҖҒH2CO3гҖҒHClOпјҢе…¶дёӯй…ёжҖ§жңҖејәзҡ„жҳҜпјҢжңҖејұзҡ„жҳҜ
-
пјҲ4пјү еҶҷеҮәдёӢеҲ—еҗ„зү©иҙЁеңЁж°ҙжә¶ж¶ІдёӯеҸ‘з”ҹз”өзҰ»зҡ„з”өзҰ»ж–№зЁӢејҸпјҺ
в‘ H2SO4
в‘ЎNH3вҖўH2O пјҺ
йҖүйЎ№ | з”І | д№ҷ |
A | з”өи§ЈиҙЁ | BaSO4гҖҒNaHSO4гҖҒSO3 |
B | ејұз”өи§ЈиҙЁзҡ„з”өзҰ» | еқҮеҲҶжӯҘз”өзҰ» |
C | еҢ–еӯҰе№іиЎЎеҪұе“Қеӣ зҙ | жё©еәҰгҖҒеҺӢејәгҖҒжө“еәҰгҖҒеӮ¬еҢ–еүӮзӯү |
D | еҢ–еӯҰз”өжәҗ | дёҖж¬Ўз”өжұ гҖҒдәҢж¬Ўз”өжұ гҖҒзҮғж–ҷз”өжұ зӯү |
в‘ 25в„ғж—¶дәҡзЎқй…ёй’ жә¶ж¶Ізҡ„pHеӨ§дәҺ7 в‘Ўз”ЁHNO2жә¶ж¶ІеҒҡеҜјз”өиҜ•йӘҢпјҢзҒҜжіЎеҫҲжҡ— в‘ўHNO2жә¶ж¶ІдёҚдёҺNa2SO4жә¶ж¶ІеҸҚеә” в‘Ј0.1molВ·L-1HNO2жә¶ж¶Ізҡ„pH=2.1
й…ё | HX | HY | HZ |
з”өзҰ»еёёж•°K/(molВ·LпјҚ1) | 9Г—10пјҚ7 | 9Г—10пјҚ6 | 1Г—10пјҚ2 |
 пјҢ1gc( CH3COOH)гҖҒ1gc(CH3COO-)гҖҒlgc(H+)е’Ң1gc(OH-)йҡҸpHеҸҳеҢ–зҡ„е…ізі»еҰӮдёӢеӣҫжүҖзӨәгҖӮKaдёәCH3COOHзҡ„з”өзҰ»еёёж•°пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
пјҢ1gc( CH3COOH)гҖҒ1gc(CH3COO-)гҖҒlgc(H+)е’Ң1gc(OH-)йҡҸpHеҸҳеҢ–зҡ„е…ізі»еҰӮдёӢеӣҫжүҖзӨәгҖӮKaдёәCH3COOHзҡ„з”өзҰ»еёёж•°пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү 
 B . NзӮ№ж—¶пјҢ
B . NзӮ№ж—¶пјҢ  C . иҜҘдҪ“зі»дёӯпјҢ
C . иҜҘдҪ“зі»дёӯпјҢ  D . pHз”ұ7еҲ°14зҡ„еҸҳеҢ–иҝҮзЁӢдёӯпјҢ CH3COO-зҡ„ж°ҙи§ЈзЁӢеәҰе§Ӣз»ҲеўһеӨ§
D . pHз”ұ7еҲ°14зҡ„еҸҳеҢ–иҝҮзЁӢдёӯпјҢ CH3COO-зҡ„ж°ҙи§ЈзЁӢеәҰе§Ӣз»ҲеўһеӨ§
 ,жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ( )
,жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ( )
 еҮҸе°Ҹ
B . еҠ ж°ҙдёҚж–ӯзЁҖйҮҠ,жә¶ж¶ІзўұжҖ§дёҖе®ҡеўһејә
C . еҠ ж°ҙзЁҖйҮҠ,е№іиЎЎеёёж•°
еҮҸе°Ҹ
B . еҠ ж°ҙдёҚж–ӯзЁҖйҮҠ,жә¶ж¶ІзўұжҖ§дёҖе®ҡеўһејә
C . еҠ ж°ҙзЁҖйҮҠ,е№іиЎЎеёёж•°  еўһеӨ§
D . еҠ е…ҘNaOHеӣәдҪ“,е№іиЎЎйҖҶеҗ‘移еҠЁ
еўһеӨ§
D . еҠ е…ҘNaOHеӣәдҪ“,е№іиЎЎйҖҶеҗ‘移еҠЁ
|
й…ёжҲ–зўұ |
з”өзҰ»е№іиЎЎеёёж•°(KaжҲ–Kb) |
|
CH3COOH |
1.8Г—10-5 |
|
HNO2 |
4.6Г—10-4 |
|
HCN |
5Г—10-10 |
|
HClO |
3Г—10-8 |
|
NH3вҖўH2O |
1.8Г—10-5 |
-
пјҲ1пјү CH3COONH4зҡ„ж°ҙжә¶ж¶Іе‘Ҳ(йҖүеЎ«вҖңй…ёжҖ§вҖқгҖҒвҖңдёӯжҖ§вҖқжҲ–вҖңзўұжҖ§вҖқ)гҖӮзҗҶз”ұжҳҜгҖӮжә¶ж¶Ідёӯеҗ„зҰ»еӯҗжө“еәҰеӨ§е°Ҹе…ізі»жҳҜгҖӮ
жё©еәҰtв„ғж—¶пјҢжҹҗNaOHзЁҖжә¶ж¶Ідёӯc(H+)=10-amol/LпјҢc(OH-)=10-bmol/LпјҢе·ІзҹҘa+b=12пјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ2пјү иҜҘжё©еәҰдёӢж°ҙзҡ„зҰ»еӯҗз§Ҝеёёж•°Kw=гҖӮ
-
пјҲ3пјү иҜҘNaOHжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»еҮәзҡ„c(OH-)жҳҜmol/LгҖӮ
-
пјҲ4пјү з»ҷиҜҘNaOHжә¶ж¶ІеҠ зғӯ(ж°ҙдёҚжҢҘеҸ‘)пјҢpH=гҖӮ(еЎ«еҸҳеӨ§гҖҒеҸҳе°ҸжҲ–дёҚеҸҳ)
-
пјҲ1пјү й’ зўұеҫӘзҺҜжі•дёӯпјҢNa2SO3жә¶ж¶Іе‘ҲзўұжҖ§зҡ„еҺҹеӣ жҳҜгҖӮ(з”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨә)
-
пјҲ2пјү е·ІзҹҘH2SO3зҡ„з”өзҰ»еёёж•°дёәпјҡK1пјқ1.5Г—10-2 пјҢ K2пјқ1.0Г—10-7пјӣH2CO3зҡ„з”өзҰ»еёёж•°дёәпјҡK1пјқ4.3Г—10-7 пјҢ K2пјқ5.6Г—10-11пјӣеҲҷдёӢеҲ—еҫ®зІ’еҸҜд»ҘеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ__(еЎ«еәҸеҸ·)гҖӮA .
 е’Ң
е’Ң  B .
B .  е’Ң
е’Ң  C . H2SO3е’Ң
C . H2SO3е’Ң  D .
D .  е’Ң
е’Ң 
-
пјҲ3пјү ж №жҚ®дёҠиҝ°дҝЎжҒҜпјҢеҪ“жә¶ж¶Ізҡ„ pHпјқ5 ж—¶пјҢжә¶ж¶Ідёӯ
 пјқ(еЎ«е…·дҪ“ж•°еҖј)гҖӮ
пјқ(еЎ«е…·дҪ“ж•°еҖј)гҖӮ
-
пјҲ4пјү еҗёж”¶ж¶Іеҗёж”¶SO2зҡ„иҝҮзЁӢдёӯпјҢж°ҙжә¶ж¶ІдёӯH2SO3гҖҒHSO3-гҖҒ
 йҡҸ pHзҡ„еҲҶеёғеҰӮеӣҫпјҡ
йҡҸ pHзҡ„еҲҶеёғеҰӮеӣҫпјҡ 
в‘ еҗёж”¶SO2еҲ¶еӨҮNaHSO3жә¶ж¶ІпјҢе®һйӘҢдёӯзЎ®е®ҡдҪ•ж—¶еҒңжӯўйҖҡSO2зҡ„е®һйӘҢж“ҚдҪңдёәгҖӮ
в‘ЎеңЁ0.1molвҖўL-1NaHSO3жә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰе…ізі»й”ҷиҜҜзҡ„жҳҜ(еЎ«еәҸеҸ·)гҖӮ
AпјҺc(Na+)пјқc(
 )+c(
)+c(  )+c(H2SO3)
)+c(H2SO3)BпјҺc(Na+)пјһc(
 )пјһc(
)пјһc(  )пјһc(OH-)
)пјһc(OH-)CпјҺc(H2SO3)+c(H+)пјқc(
 )+c(OH-)
)+c(OH-)DпјҺc(Na+)+c(H+)пјқc(
 )+c(
)+c(  )+c(OH-)
)+c(OH-) -
пјҲ5пјү дәҡзЎ«й…°ж°Ҝ(SOCl2 )еҸҲеҗҚж°ҜеҢ–дәҡз ңпјҢжҳҜдёҖз§Қж¶ІжҖҒзҡ„йқһз”өи§ЈиҙЁпјҢжІёзӮ№дёә 77в„ғпјҺSOCl2дёӯж°Ҝе…ғзҙ дёҺзЎ«е…ғзҙ зӣҙжҺҘд»Ҙе…ұд»·й”®зӣёиҝһпјҢе…¶дёӯ Cl е‘Ҳ-1д»·пјӣSOCl2йҒҮж°ҙеҸҜз”ҹжҲҗSO2гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡи’ёе№ІMgCl2жә¶ж¶ІдёҚиғҪеҫ—еҲ°ж— ж°ҙMgCl2 пјҢ иӢҘе°ҶSOCl2дёҺMgCl2вҖў6H2Oж··еҗҲ并еҠ зғӯпјҢеҸҜеҲ¶еҫ—ж— ж°ҙMgCl2 пјҢ иҜ·з”ЁSOCl2дёҺж°ҙеҸҚеә”зҡ„ж–№зЁӢејҸе’Ңеҝ…иҰҒзҡ„ж–Үеӯ—жҸҸиҝ°и§ЈйҮҠеҺҹеӣ гҖӮ
 еӮЁж°ўжқҗж–ҷгҖҒзҮғж–ҷз”өжұ зӯүж–№йқўе…·жңүйҮҚиҰҒеә”з”ЁгҖӮ
еӮЁж°ўжқҗж–ҷгҖҒзҮғж–ҷз”өжұ зӯүж–№йқўе…·жңүйҮҚиҰҒеә”з”ЁгҖӮ
-
пјҲ1пјү
 дёӯHе…ғзҙ зҡ„еҢ–еҗҲд»·дёә
дёӯHе…ғзҙ зҡ„еҢ–еҗҲд»·дёә  пјҢе…·жңүејәиҝҳеҺҹжҖ§пјҢдёҖе®ҡжқЎд»¶дёӢпјҢеҗ‘
пјҢе…·жңүејәиҝҳеҺҹжҖ§пјҢдёҖе®ҡжқЎд»¶дёӢпјҢеҗ‘  жә¶ж¶Ідёӯж»ҙеҠ зўұжҖ§
жә¶ж¶Ідёӯж»ҙеҠ зўұжҖ§  жә¶ж¶ІпјҢжә¶ж¶Ідёӯ
жә¶ж¶ІпјҢжә¶ж¶Ідёӯ  дёҺ
дёҺ  еҸҚеә”з”ҹжҲҗзәізұій“ҒзІүгҖҒ
еҸҚеә”з”ҹжҲҗзәізұій“ҒзІүгҖҒ  е’Ң
е’Ң  пјҢеҸӮеҠ еҸҚеә”зҡ„
пјҢеҸӮеҠ еҸҚеә”зҡ„  дёҺз”ҹжҲҗзҡ„зәізұій“ҒзІүзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәгҖӮ
дёҺз”ҹжҲҗзҡ„зәізұій“ҒзІүзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәгҖӮ
-
пјҲ2пјү
 зҮғж–ҷз”өжұ дёӯпјҢ
зҮғж–ҷз”өжұ дёӯпјҢ  иҪ¬еҢ–дёә
иҪ¬еҢ–дёә  пјҢз”өи§Ј
пјҢз”өи§Ј  жә¶ж¶ІеҸҲеҸҜеҲ¶еҫ—
жә¶ж¶ІеҸҲеҸҜеҲ¶еҫ—  пјҢе®һзҺ°зү©иҙЁзҡ„еҫӘзҺҜеҲ©з”ЁпјҢз”өи§ЈиЈ…зҪ®зӨәж„ҸеӣҫеҰӮеӣҫжүҖзӨәгҖӮ
пјҢе®һзҺ°зү©иҙЁзҡ„еҫӘзҺҜеҲ©з”ЁпјҢз”өи§ЈиЈ…зҪ®зӨәж„ҸеӣҫеҰӮеӣҫжүҖзӨәгҖӮ 
в‘ з”өи§Јжұ йҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәгҖӮ
в‘ЎдёӨз”өжһҒеҢәй—ҙдҪҝз”ЁйҳізҰ»еӯҗдәӨжҚўиҶңпјҢдёҚе…Ғи®ёйҳҙзҰ»еӯҗйҖҡиҝҮзҡ„еҺҹеӣ жҳҜгҖӮ
-
пјҲ3пјү
 еӮ¬еҢ–йҮҠж°ўгҖӮеңЁеӮ¬еҢ–еүӮдҪңз”ЁдёӢпјҢ
еӮ¬еҢ–йҮҠж°ўгҖӮеңЁеӮ¬еҢ–еүӮдҪңз”ЁдёӢпјҢ  дёҺж°ҙеҸҚеә”з”ҹжҲҗ
дёҺж°ҙеҸҚеә”з”ҹжҲҗ  пјҢеҸҜиғҪзҡ„еҸҚеә”жңәзҗҶеҰӮеӣҫжүҖзӨәгҖӮ
пјҢеҸҜиғҪзҡ„еҸҚеә”жңәзҗҶеҰӮеӣҫжүҖзӨәгҖӮ 
в‘ е…¶д»–жқЎд»¶дёҚеҸҳж—¶пјҢд»Ҙ
 д»Јжӣҝ
д»Јжӣҝ  еӮ¬еҢ–йҮҠж°ўпјҢжүҖеҫ—ж°”дҪ“зҡ„еҲҶеӯҗејҸдёәгҖӮ
еӮ¬еҢ–йҮҠж°ўпјҢжүҖеҫ—ж°”дҪ“зҡ„еҲҶеӯҗејҸдёәгҖӮв‘Ўе·ІзҹҘпјҡ
 дёәдёҖе…ғејұй…ёпјҢ
дёәдёҖе…ғејұй…ёпјҢ  ж°ҙжә¶ж¶Іе‘Ҳй…ёжҖ§зҡ„еҺҹеӣ жҳҜ(з”ЁзҰ»еӯҗж–№ејҸиЎЁзӨә)гҖӮ
ж°ҙжә¶ж¶Іе‘Ҳй…ёжҖ§зҡ„еҺҹеӣ жҳҜ(з”ЁзҰ»еӯҗж–№ејҸиЎЁзӨә)гҖӮ -
пјҲ4пјү еңЁеӮ¬еҢ–еүӮзҡ„дҪңз”ЁдёӢпјҢ
 дёҺж°ҙеҸҚеә”пјҢйҮҠж°ўдҪ“з§ҜеҸҠжё©еәҰйҡҸеҸҚеә”ж—¶й—ҙзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮ
дёҺж°ҙеҸҚеә”пјҢйҮҠж°ўдҪ“з§ҜеҸҠжё©еәҰйҡҸеҸҚеә”ж—¶й—ҙзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮ 
в‘ 0~20minеҶ…пјҢжё©еәҰйҡҸж—¶й—ҙеҝ«йҖҹеҚҮй«ҳзҡ„еҺҹеӣ жҳҜгҖӮ
в‘Ў20minеҗҺпјҢж°ўж°”дҪ“з§ҜеңЁеўһеҠ пјҢиҖҢжё©еәҰеҚҙдёӢйҷҚзҡ„еҺҹеӣ жҳҜгҖӮ
 зҡ„ж°ҙжә¶ж¶ІиғҪеҜјз”өпјҢж¶ІжҖҒ
зҡ„ж°ҙжә¶ж¶ІиғҪеҜјз”өпјҢж¶ІжҖҒ дёҚеҜјз”өпјҢеӣ жӯӨзӣҗй…ёжҳҜз”өи§ЈиҙЁ
B . ж°Ёж°ҙгҖҒй“ңдёқйғҪиғҪеҜјз”өпјҢдҪҶеқҮдёҚжҳҜз”өи§ЈиҙЁпјҢд№ҹдёҚжҳҜйқһз”өи§ЈиҙЁ
C .
дёҚеҜјз”өпјҢеӣ жӯӨзӣҗй…ёжҳҜз”өи§ЈиҙЁ
B . ж°Ёж°ҙгҖҒй“ңдёқйғҪиғҪеҜјз”өпјҢдҪҶеқҮдёҚжҳҜз”өи§ЈиҙЁпјҢд№ҹдёҚжҳҜйқһз”өи§ЈиҙЁ
C .  еҸҜд»ҘиЎЁзӨәжүҖжңүејәзўұе’ҢеҸҜжә¶жҖ§й“ңзӣҗд№Ӣй—ҙзҡ„еҸҚеә”
D . зўій…ёй’ дёҺзӣҗй…ёеҸҚеә”пјҢзўій…ёж°ўй’ дёҺзӣҗй…ёеҸҚеә”еҸҜд»Ҙз”ЁеҗҢдёҖдёӘзҰ»еӯҗж–№зЁӢејҸиЎЁзӨә
еҸҜд»ҘиЎЁзӨәжүҖжңүејәзўұе’ҢеҸҜжә¶жҖ§й“ңзӣҗд№Ӣй—ҙзҡ„еҸҚеә”
D . зўій…ёй’ дёҺзӣҗй…ёеҸҚеә”пјҢзўій…ёж°ўй’ дёҺзӣҗй…ёеҸҚеә”еҸҜд»Ҙз”ЁеҗҢдёҖдёӘзҰ»еӯҗж–№зЁӢејҸиЎЁзӨә
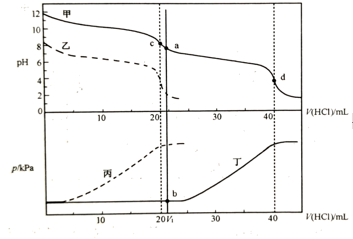
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„зҡ„жҳҜпјҲ пјү
 +H+=CO2вҶ‘+H2O
C . ж №жҚ®pHвҖ”V(HCl)еӣҫпјҢж»ҙе®ҡеҲҶжһҗж—¶пјҢcзӮ№еҸҜз”Ёй…ҡй…һгҖҒdзӮ№еҸҜз”Ёз”Іеҹәж©ҷдҪңжҢҮзӨәеүӮжҢҮзӨәж»ҙе®ҡз»ҲзӮ№
D . Na2CO3е’ҢNaHCO3жә¶ж¶ІдёӯеқҮж»Ўи¶іпјҡc(H2CO3)-c(CO
+H+=CO2вҶ‘+H2O
C . ж №жҚ®pHвҖ”V(HCl)еӣҫпјҢж»ҙе®ҡеҲҶжһҗж—¶пјҢcзӮ№еҸҜз”Ёй…ҡй…һгҖҒdзӮ№еҸҜз”Ёз”Іеҹәж©ҷдҪңжҢҮзӨәеүӮжҢҮзӨәж»ҙе®ҡз»ҲзӮ№
D . Na2CO3е’ҢNaHCO3жә¶ж¶ІдёӯеқҮж»Ўи¶іпјҡc(H2CO3)-c(CO )=c(OH-)-c(H+)
)=c(OH-)-c(H+)
 )пјһc(Na+)
B . и¶ійҮҸзҡ„й”ҢеҲҶеҲ«дёҺзӯүдҪ“з§Ҝзӯүжө“еәҰзҡ„зЁҖзЎ«й…ёе’ҢйҶӢй…ёе®Ңе…ЁеҸҚеә”пјҢеңЁзӣёеҗҢжқЎд»¶дёӢдә§з”ҹзҡ„ж°ўж°”дҪ“з§ҜзӣёеҗҢ
C . 35в„ғж—¶пјҢзәҜж°ҙдёӯc(H+)пјһc(OH-)
D . еёёжё©дёӢпјҢе°ҶpH=3зҡ„йҶӢй…ёжә¶ж¶ІзЁҖйҮҠеҲ°еҺҹдҪ“з§Ҝзҡ„10еҖҚеҗҺпјҢжә¶ж¶Ізҡ„pH=4
)пјһc(Na+)
B . и¶ійҮҸзҡ„й”ҢеҲҶеҲ«дёҺзӯүдҪ“з§Ҝзӯүжө“еәҰзҡ„зЁҖзЎ«й…ёе’ҢйҶӢй…ёе®Ңе…ЁеҸҚеә”пјҢеңЁзӣёеҗҢжқЎд»¶дёӢдә§з”ҹзҡ„ж°ўж°”дҪ“з§ҜзӣёеҗҢ
C . 35в„ғж—¶пјҢзәҜж°ҙдёӯc(H+)пјһc(OH-)
D . еёёжё©дёӢпјҢе°ҶpH=3зҡ„йҶӢй…ёжә¶ж¶ІзЁҖйҮҠеҲ°еҺҹдҪ“з§Ҝзҡ„10еҖҚеҗҺпјҢжә¶ж¶Ізҡ„pH=4



