第一节 原电池 知识点题库
某金属能与盐酸反应产生氢气,该金属与锌组成的原电池中,锌为负极.该金属为( )
A . 铝
B . 铜
C . 铁
D . 镁
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。电池以金属锂和钢板为电极材料,LiOH 为电解质,使用时加入水即可放电。关于该电池的说法正确的是( )
A . 钢板为正极,发生还原反应
B . 放电时电子的流向:正极→导线→负极
C . 放电时 OH-向正极移动
D . 总反应为:2Li+2H+= 2Li++H2↑
下列说法正确的是( )
A . 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l) 能自发进行,则其ΔH<0
B . 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
C . 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
D . 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为Na1-mCoO2+NamCn  NaCoO2+Cn。下列说法错误的是()
NaCoO2+Cn。下列说法错误的是()
 NaCoO2+Cn。下列说法错误的是()
NaCoO2+Cn。下列说法错误的是()
A . 放电时,Na+向正极移动
B . 放电时,负极的电极反应式为NamCn-me-=mNa++Cn
C . 充电时,阴极质量减小
D . 充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是()

A . 充电时阴极发生氧化反应
B . 充电时将碳电极与电源的正极相连
C . 放电时碳电极反应为原电池的负极
D . 放电时镍电极反应为Ni(OH)2-e-+OH-=NiO(OH)+H2O
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )
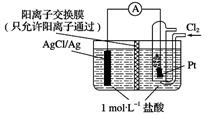
A . 正极反应为AgCl+e-=Ag+Cl-
B . 负极反应为Ag-e-=Ag+
C . 放电时,交换膜右侧溶液中有大量白色沉淀生成
D . 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
锌铜原电池(如图)工作时,下列叙述正确的是( )
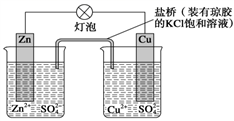
A . 正极反应为Zn-2e-=Zn2+
B . 电池反应为Zn+Cu2+=Zn2++Cu
C . 盐桥中的K+移向ZnSO4溶液
D . 在外电路中,电流从负极流向正极
某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收 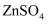 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
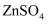 溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:
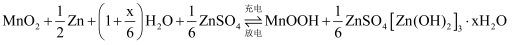

下列说法中,正确的是( )
A . 充电时,  移向Zn膜
B . 充电时,含有
移向Zn膜
B . 充电时,含有  膜的碳纳米管纤维一端连接有机高聚物电源负极
C . 放电时,电子由锌膜表面经有机高聚物至
膜的碳纳米管纤维一端连接有机高聚物电源负极
C . 放电时,电子由锌膜表面经有机高聚物至  膜表面
D . 放电时,电池的负极反应为:
膜表面
D . 放电时,电池的负极反应为: 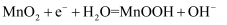
 移向Zn膜
B . 充电时,含有
移向Zn膜
B . 充电时,含有  膜的碳纳米管纤维一端连接有机高聚物电源负极
C . 放电时,电子由锌膜表面经有机高聚物至
膜的碳纳米管纤维一端连接有机高聚物电源负极
C . 放电时,电子由锌膜表面经有机高聚物至  膜表面
D . 放电时,电池的负极反应为:
膜表面
D . 放电时,电池的负极反应为: 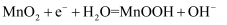
根据图,下列判断正确的是( )
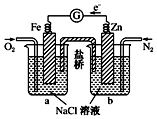
A . 电子从Zn极流出,流入Fe极,经盐桥回到Zn极
B . 烧杯b中发生的电极反应为 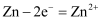 C . 烧杯a中发生反应
C . 烧杯a中发生反应 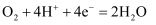 ,溶液pH降低
D . 向烧杯a中加入少量KSCN溶液,则溶液会变成红色
,溶液pH降低
D . 向烧杯a中加入少量KSCN溶液,则溶液会变成红色
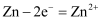 C . 烧杯a中发生反应
C . 烧杯a中发生反应 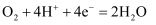 ,溶液pH降低
D . 向烧杯a中加入少量KSCN溶液,则溶液会变成红色
,溶液pH降低
D . 向烧杯a中加入少量KSCN溶液,则溶液会变成红色
化学能与电能之间可以相互转化。
-
(1) 直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是 _____A . Ba(OH)2·8H2O与NH4Cl反应 B . 氢氧化钠与稀盐酸反应 C . 灼热的炭与 CO2 反应 D . H2 与 Cl2 燃烧反应
-
(2) 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为: 。
②电池工作时 OH-向 移动(填“正极”或“负极”)。
③正极上消耗标况下 4.48L 气体时, 转移电子的数目为 。
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH +2H2O  Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是( )
 Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是( )
A . 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
B . 放电时负极附近溶液的pH不变
C . 放电时电解质溶液中的OH-向正极移动
D . 充电时Cd与外电源的正极相连
某氨气燃料电池,如图所示,下列说法错误的是( )

A . 正极的电极反应式为O2+4e-+4H+=2H2O
B . 电子流向:电极1→负载→电极2
C . Na+由左向右移动
D . NH3在电极1上发生氧化反应
由A、B、C、D四种金属按下表中装置进行实验。
|
甲 |
乙 |
丙 |
|
|
装置 |
| | |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
-
(1) 装置甲中作正极的是(填“A”或“B”)。
-
(2) 装置乙溶液中C电极反应式为。
-
(3) 装置丙中金属A上电极反应属于(填“氧化反应”或“还原反应”)。
-
(4) 四种金属活动性由强到弱的顺序是。
如图为以稀H2SO4为电解质溶液,Pt为电极的氢氧燃料电池的工作原理示意图。下列有关说法错误的是( )
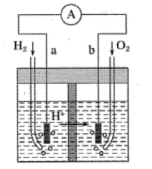
A . 氢氧燃料电池是一种具有应用前景的绿色电源
B . a极为负极,电子由a极经外电路流向b极
C . b极的电极反应式为:O2+4H++4e-=2H2O
D . 电池工作一段时间后,装置中c(H2SO4)不变
聚合硫酸铁{PFS,  }是一种性能优越的无机高分子混凝剂,利用双极膜(BP)(由一张阳膜和一张阴膜复合制成,在直流电场作用下将水分子解离成
}是一种性能优越的无机高分子混凝剂,利用双极膜(BP)(由一张阳膜和一张阴膜复合制成,在直流电场作用下将水分子解离成  和
和 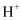 ,作为
,作为 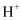 和
和  离子源)电渗析法制备PFS的装置如图所示,下列说法错误的是( )
离子源)电渗析法制备PFS的装置如图所示,下列说法错误的是( )
 }是一种性能优越的无机高分子混凝剂,利用双极膜(BP)(由一张阳膜和一张阴膜复合制成,在直流电场作用下将水分子解离成
}是一种性能优越的无机高分子混凝剂,利用双极膜(BP)(由一张阳膜和一张阴膜复合制成,在直流电场作用下将水分子解离成  和
和 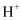 ,作为
,作为 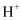 和
和  离子源)电渗析法制备PFS的装置如图所示,下列说法错误的是( )
离子源)电渗析法制备PFS的装置如图所示,下列说法错误的是( ) 
A . X极上发生的电极反应为  B . “室1”和“室3”得到
B . “室1”和“室3”得到 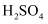 和
和  的混合液
C . “室2”和“室4”产品为浓PFS
D . 双极膜向“室2”和“室4”中提供
的混合液
C . “室2”和“室4”产品为浓PFS
D . 双极膜向“室2”和“室4”中提供 
 B . “室1”和“室3”得到
B . “室1”和“室3”得到 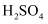 和
和  的混合液
C . “室2”和“室4”产品为浓PFS
D . 双极膜向“室2”和“室4”中提供
的混合液
C . “室2”和“室4”产品为浓PFS
D . 双极膜向“室2”和“室4”中提供 
包覆纳米硅复合材料(GS-Si)的可充电石墨烯电池工作原理如图所示。放电时,GS-Si包覆石墨烯电极上的物质变化为:C6Li→C6Li1-x;多元含锂过渡金属氧化物电极上的物质变化为:Li1-xMO2→LiMO2 , 下列说法错误的是( )
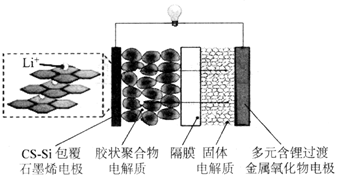
A . 放电时,胶状聚合物电解质和固体电解质的作用均为传导离子,构成闭合回路
B . 若放电前两个电极质量相等,转移0.1mol电子后两个电极质量相差0.7g
C . 充电时,与正极连接的电极反应为LiMO2-xe-=Lil-xMO2+xLi+
D . 为保护电池,GS-Si包覆石墨烯的电极反应不能进行至C6Li-e-=C6+Li+
下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。
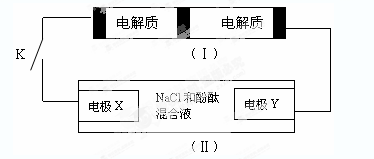
装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为2Na2S2+NaBr3化气  Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是( )
Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是( )
A . 闭合开关K时,钠离子从右到左通过离子交换膜
B . 闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+
C . 闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑
D . 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
CH3OH和O2构成的质子交换膜燃料电池的结构如图所示,电池总反应为  。下列说法错误的是( )
。下列说法错误的是( )
 。下列说法错误的是( )
。下列说法错误的是( ) 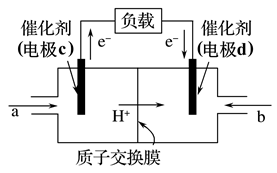
A . 电极d是正极,发生还原反应
B . 电极c的电极反应式为  C . 当外电路中转移2mol电子时,消耗11.2L氧气
D . 利用该装置将化学能转化为电能
C . 当外电路中转移2mol电子时,消耗11.2L氧气
D . 利用该装置将化学能转化为电能
 C . 当外电路中转移2mol电子时,消耗11.2L氧气
D . 利用该装置将化学能转化为电能
C . 当外电路中转移2mol电子时,消耗11.2L氧气
D . 利用该装置将化学能转化为电能
新型NaBH4/H2O2燃料电池(DBFC)的结构如图,该电池总反应方程式为NaBH4+4H2O2=NaBO2+6H2O。下列有关说法中正确的是 ( )

A . 电池正极区的电极反应为BH +8OH- -8e- = BO
+8OH- -8e- = BO +6 H2O
B . 电极B为负极,纳米MnO2层的作用是提高原电池的工作效率
C . 燃料电池每消耗3 mol H2O2 , 理论上通过电路中的电子数为6NA
D . 燃料电池在放电过程中,Na+从正极区向负极区迁移
+6 H2O
B . 电极B为负极,纳米MnO2层的作用是提高原电池的工作效率
C . 燃料电池每消耗3 mol H2O2 , 理论上通过电路中的电子数为6NA
D . 燃料电池在放电过程中,Na+从正极区向负极区迁移
 +8OH- -8e- = BO
+8OH- -8e- = BO +6 H2O
B . 电极B为负极,纳米MnO2层的作用是提高原电池的工作效率
C . 燃料电池每消耗3 mol H2O2 , 理论上通过电路中的电子数为6NA
D . 燃料电池在放电过程中,Na+从正极区向负极区迁移
+6 H2O
B . 电极B为负极,纳米MnO2层的作用是提高原电池的工作效率
C . 燃料电池每消耗3 mol H2O2 , 理论上通过电路中的电子数为6NA
D . 燃料电池在放电过程中,Na+从正极区向负极区迁移
-
(1) Ⅰ.现有如下两个反应:A .
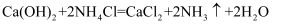 B .
B . 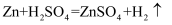
上述反应属于放热反应的是_______(填“A”或“B”)。
-
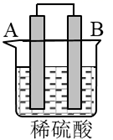
(2) 将纯锌片和纯铜片按图方式插入
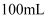 相同浓度的稀硫酸中一段时间,回答下列问题:
相同浓度的稀硫酸中一段时间,回答下列问题:
①在甲乙两个烧杯中,甲铜极上发生反应(填“氧化”或“还原”),乙在表面产生气泡(填“
 ”或“
”或“ ”)。
”)。②能构成原电池的是装置(填“甲”或“乙”),其中负极为电极(填“
 ”或“
”或“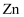 ”)。
”)。③两个装置中
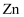 均被腐蚀,若转移
均被腐蚀,若转移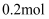 电子,理论上
电子,理论上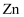 片质量减轻g。
片质量减轻g。 -
(3) 在进行上述实验时发现甲放出气泡的速率较快,为了加快乙的反应速率,可采用的措施有(写出一种即可)。
-
(4) II.一定条件下,在密闭容器中充入一定量的
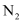 和
和 发生反应:
发生反应: , 各物质的浓度变化如图所示。
, 各物质的浓度变化如图所示。
 内,平均反应速率
内,平均反应速率 为。
为。 -
(5) 下列叙述能说明该反应已达到平衡状态的是____。A .
 B . 密闭容器内气体总质量保持不变
C . 各物质的浓度保持不变
D . 消耗
B . 密闭容器内气体总质量保持不变
C . 各物质的浓度保持不变
D . 消耗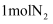 的同时生成
的同时生成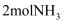
最近更新