第一章 原子结构与性质 知识点题库
①光气(COCl2)②六氟化硫③HCHO④三氟化硼⑤PCl3⑥PCl5⑦NO2⑧二氟化氙⑨N2⑩CH4 .
-
(1) Fe、Co、Ni在周期表中的位置为,基态Fe原子的价电子排布式为。
-
(2) C、N、O、Fe的第一电离能由大到小的顺序为,C、N、O最简单氢化物的沸点由高到低的顺序为 。
-
(3) C2H2分子中空间构型为,N2H4分子中心原子的杂化方式为。
-
(4) Fe、Co、Ni能与Cl2反应,其中Co和Ni均生成二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:。
-
(5) CoO的面心立方晶胞如图所示。三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。设阿伏加德罗常数的值为NA , 则CoO晶体的密度为g∙cm-3。

-
(1) 基态铜原子价层电子排布图为,其核外占据最高能层电子的电子云轮廓图的形状为。
-
(2)
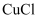 晶胞结构如下图所示。
晶胞结构如下图所示。 ①区别晶体与非晶体最科学的方法是;该晶胞中铜原子的配位数为。
②若位于O点的
 原子的坐标为(0,0,0),A点的Cu原子的坐标为(0,
原子的坐标为(0,0,0),A点的Cu原子的坐标为(0,  ,
,  ),则晶胞中距离O点最近的
),则晶胞中距离O点最近的  原子的坐标为。
原子的坐标为。
-
(3) 某铜氧化合物是一种杀菌剂和陶瓷的着色剂,其立方晶胞如图所示。

①该铜氧化合物的化学式为。
②若
 原子之间最短距离为
原子之间最短距离为  ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为  ,该晶体的密度为
,该晶体的密度为  (列出计算式即可)。
(列出计算式即可)。
|
微粒代号 |
组成特点 |
|
A |
简单阴离子,有强还原性,带2个单位负电荷 |
|
B |
化合物,六核分子,有还原性,可作火箭燃料 |
|
C |
化合物,四核分子,有强氧化性 |
|
D |
同种元素的原子形成的双核阴离子,带两个单位负电荷,有强氧化性 |
|
E |
简单阳离子,带2个单位正电荷 |
|
F |
简单阳离子,带1个单位正电荷 |
请用合适的化学用语回答下列问题:
-
(1) 写出E微粒代表的元素的原子结构示意图;B的电子式;C的结构式。
-
(2) 用电子式表示A、F组成的化合物的形成过程。
-
(3) 由E和D形成的化合物中存在的化学键类型是。
-
(4) 对B的沸点有影响的作用力有(填正确答案标号)。
a.离子键 b.非极性键 c.分子间作用力 d.氢键 e.极性键
-
(5) 将A对应的钠盐加入C的酸性溶液中,溶液变浑浊,该反应的离子方程式是。
-
(1) 基态硫原子的价电子排布式为,其电子占据最高能级的电子云轮廓图形状为;
-
(2) 常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为,原因是。
-
(3) 炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是,SO2中心原子的价层电子对数为。
-
(4) 方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有;
A.H2O B.CO2 C.SO2 D.CH4
-
(5) 方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为
 g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm
g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm 
选项 | 实验事实 | 理论解释 |
A | 环状S8分子结构如图 | S原子采取的杂化方式为sp3 |
B | SO2易溶于水而难溶于CCl4 | SO2和水都是极性分子而CCl4为非极性分子 |
C | HF分子热稳定性比HCl强 | HF分子间作用力比HCl强 |
D | Fe2+比Fe3+的稳定性小 | Fe2+和Fe3+的价电子排布式分别为3d6、3d5 , Fe3+的3d能级为半充满的稳定结构 |
 等。
等。
-
(1)
 , 中所含元素H、O、P、S的电负性从大到小的顺序为 ;CH3NH2的沸点是-6.8℃,CH3CH3的沸点是-88.6℃ ,CH3NH2的沸点远高于CH3CH3的沸点的原因是。
, 中所含元素H、O、P、S的电负性从大到小的顺序为 ;CH3NH2的沸点是-6.8℃,CH3CH3的沸点是-88.6℃ ,CH3NH2的沸点远高于CH3CH3的沸点的原因是。
-
(2) H2O、H2S、H2Se中最稳定的是(填化学式,下同),还原性最强的是,键角最大的是。
-
(3) SO3和O3的混合气体经光解作用可生成一种新分子
 。
。①SO3中S的杂化轨道与O的2p轨道重叠形成σ键。
②下列分子中属于非极性分子的是 (填序号)。
a.SO3
b.O3
c.

d.CH3F
e.P4
-
(4) 已知酸性:ClCH2COOH>CH3COOH。推测酸性:ClCH2COOH(填“>”或“<")FCH2COOH。
-
(1) 基态Co的价层电子排布式是3d74s2 , 轨道表示式是
 。在元素周期表中,该元素属于(填“d”或“ds”)区。
。在元素周期表中,该元素属于(填“d”或“ds”)区。
-
(2) [Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3。NH3的空间结构呈形,是(填“极性”或“非极性”)分子。
②该配合物中Co3+参与杂化的6个能量相近的空轨道分别是2个3d、1个和3个。
③设计实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。
实验如下:称取2.51g该配合物,先加水溶解,再加足量AgNO3溶液,(补全实验操作和数据)。
相对分子质量:[Co(NH3)5Cl]Cl2-250.5,AgCl-143.5。
-
(3) 钴蓝可用于青花瓷的颜料。钴蓝晶体是由图1所示的结构平移构成。图1包含Ⅰ型和Ⅱ型两种小立方体。图2是钴蓝的晶胞。

①图2中Ⅱ型小立方体分别是b、(填字母序号)。
②钴蓝晶体中三种原子个数比N(Co):N(Al):N(O)=。
-
(1) 基态铜原子价电子排布式为。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)I2(Cu) (填“>”“<”或“=”),并解释有关原因。
-
(2)
 的空间构型为。
的空间构型为。
-
(3) 我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是(填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为。

-
(4) 黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3 , 则阿伏加德罗常数(NA)为mol-1(用a、b、ρ表示,并化成最简)。
-
(1) 基态氮原子中含有种运动状态不同的电子,与N3-含有相同电子数的3原子分子是(写化学式),其中心原子价层电子对构型是。
-
(2) 砷在元素周期表中的位置,Sb的质子数为。
-
(3) 科学家目前合成了N4分子,N4分子中氮原子的杂化轨道类型是,N-N-N键角为。

-
(4) 已知:含1 mol P原子的白磷转化为黑磷要放出39.3 kJ的能量;转化为红磷要放出17.6 kJ的能量;由此推知,其中最稳定的磷单质是。(填物质名称)
-
(5) 与PH3互为等电子体的一种离子(写化学式)。
-
(1) W在元素周期表中的位置为,其基态原子中成对电子数与未成对电子数之比为。
-
(2) X、Y、Z三种元素的第一电离能由大到小的顺序是(用元素符号表示)。
-
(3) X的最简单氢化物与其最高价氧化物对应的水化物反应的化学方程式为,产物的阴、阳离子的空间结构分别为、。
-
(4) 向
 溶液中加入过量
溶液中加入过量 水溶液,生成的产物阳离子
水溶液,生成的产物阳离子 含有的化学键类型为。
含有的化学键类型为。
-
(5) 最简单氢化物的键角:Y(填“>”或“<”)Z,原因是。




