第一节 共价键 知识点题库


 、
、  、
、  中,所有原子都满足最外层8电子的稳定结构
B . 在元素周期表中金属和非金属交界处可以找到半导体材料
C . 由非金属元素组成的化合物一定是共价化合物
D . 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
中,所有原子都满足最外层8电子的稳定结构
B . 在元素周期表中金属和非金属交界处可以找到半导体材料
C . 由非金属元素组成的化合物一定是共价化合物
D . 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
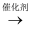 CO2+H2O △H<0。下列有关说法正确的是 ( )
CO2+H2O △H<0。下列有关说法正确的是 ( )
|
表述Ⅰ |
表述Ⅱ |
|
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中Cl—与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比SiH4分子稳定性高 |
Si的原子半径比C的大,Si与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
-
(1) R在元素周期表中的位置为。
-
(2) R2Z2的电子式为。
-
(3) X、Z两元素形成原子个数比为1:1的化合物中含有的化学键类型为 (填写“离子键”或“共价键”)
-
(4) Z、Q、M简单离子半径由大到小的顺序为 (写元素离子符号)。
-
(5) M的单质与R的最高价氧化物对应水化物反应的离子方程式为。
-
(6) 由X、Y、Z三种元素形成的盐类化合物的水溶液呈酸性的原因: (用离子方程式表示)。
①在水中氢、氧原子间均以化学键相结合 ②所有金属和非金属化合形成离子键 ③离子键是阳离子、阴离子的相互吸引 ④两个非金属原子间不可能形成离子键 ⑤非金属原子间不可能形成离子键 ⑥离子化合物中可能有共价键 ⑦共价化合物中不可能有离子键


 D . H2O2的电子式:
D . H2O2的电子式:
-
(1) 石英砂制粗硅的化学方程式为。
-
(2) 处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。在基态14C原子中,核外存在对自旋相反的电子。
-
(3) 碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示。
 (金刚石晶体)
(金刚石晶体) (石墨烯晶体)
(石墨烯晶体)①在石墨烯晶体中,每个六元环占有个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接个六元环。
③写出金刚石的硬度大于晶体硅的原因:。
-
(4) SiO2的晶体类型是晶体,一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链如下图所示。其中Si原子的杂化轨道类型是。
-
(5) 写出SiCl4的电子式:,H2还原气态SiCl4可制得纯硅,1100℃时每生成0.56kg纯硅需吸收akJ热量,写出该反应的热化学方程式:。
-
(1) 基态氧原子的电子排布式是。
-
(2) H2O分子的VSEPR模型是形。
-
(3) 对H2O2分子结构的研究,曾有以下推测:

①根据测定H2O2分子中(填字母序号),确定其结构一定不是甲。
a.H-O键长 b.O-O键能 c.H-O-O键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素(
 )与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。a.H2O2为(填“极性”或“非极性”)分子。
b.用“X—H…Y”表示出上述晶体中形成的氢键:。
-
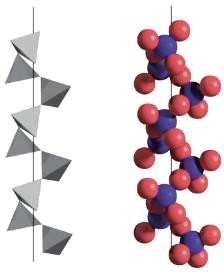
(4) O2的晶胞为立方体,结构如下。
根据图中信息,可计算O2晶体密度是g·cm-3。
-
(5) 已知O3分子空间结构为V形,中心O为sp2杂化。除σ键外,O3分子中还形成了含4个电子的大π键。每个O3分子中用于成键的电子总数是个,中心O提供参与成键的电子数是个。
-
(1)
 与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验
与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验 。
。
①基态
 核外电子排布式为。
核外电子排布式为。②丁二酮肟镍分子中
 采取
采取 杂化,为平面正方形构型,则该分子中共面的原子最多为个。
杂化,为平面正方形构型,则该分子中共面的原子最多为个。③丁二酮肟镍分子内存在的化学键有(填标号)。
A.离子键 B.配位键 C.氢键 D.范德华力
-
(2) 镍能形成多种配合物,如
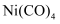 、
、 等。
等。①
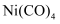 晶体中含有的
晶体中含有的 键与
键与 键数目之比为。
键数目之比为。②
 中键角H-N-H比独立存在的
中键角H-N-H比独立存在的 分子中键角略大,其原因是。
分子中键角略大,其原因是。 -
(3) 苯与
 在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳
在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳 键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知
键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知 键长为
键长为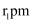 ,
,  键长为
键长为 。
。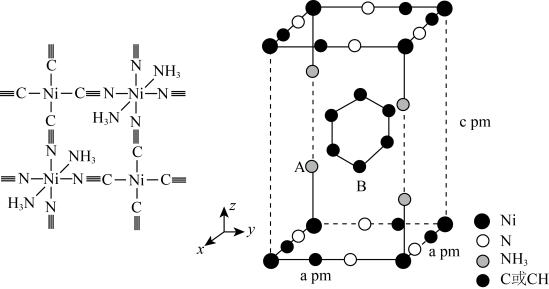
则该晶体的化学式为;A点的分数坐标为;晶胞中A、B间距离d=pm。
-
(1) 上述物质所涉元素中位于d区的是 ,所涉非金属元素电负性最小的是。
-
(2) 第一电离能:I1(Cu) I1(Zn)(填“>”或“<”,下同);第二电离能:I2 (Zn)I2(Cu),其理由是。
-
(3) CO2分子中心原子与氧原子形成σ键。
-
(4) ZnO与强碱反应生成[Zn(OH)4]2- , [Zn(OH)4]2-中提供孤电子对的元素是 , 中心离子杂化轨道类型是sp3杂化,[Zn(OH)4]2-立体构型为。
-
(5) ZnO沸点为2360℃;二氧化碳的沸点为—78.5 ℃,甲醇的沸点为64.7℃,三者沸点差异的原因是。
-
(6) 由Cu和O组成的某晶胞结构如图,该氧化物的化学式为,若该晶体的密度为dg· cm-3 , Cu和O的原子半径分别为bpm和q pm,阿伏加德罗常数值为NA , 晶胞中原子的空间利用率为(列出计算式即可)。




