专题5 微观结构与物质的多样性 知识点题库
具有下列电子排布式的原子中,半径最大的为( )
A . 1s22s22p63s1
B . 1s22s22p63s23p64s1
C . 1s22s22p63s2
D . 1s22s22p63s23p64s2
下图为元素周期表短周期的一部分,乙原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是( )
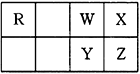
A . 氢和R、W三种元素形成的阴离子有3种以上
B . RY2分子中每个原子的最外层均为8电子结构
C . R、Y、Z的最高价氧化物对应水化物的酸性依次增强
D . X、Z的氢化物的热稳定性和还原性,都依次减弱
下列物质中所含的化学键只有离子键的是( )
A . KCl
B . NaOH
C . HCl
D . SO3
-
(1) 配平化学反应方程式并标出电子转移的方向和总数:
Fe(NO3)3 +NaOH + Cl2 → Na2FeO4 +NaNO3 + NaCl + H2O,
-
(2) 上述反应中元素被氧化,发生还原反应的物质是
-
(3) 写出铁元素在元素周期表中的位置是第周期第族
-
(4) 写出上述反应中还原产物的电子式
-
(5) 若反应中转移了0.1 mol电子,则消耗了L Cl2(标准状况)。
W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )

A . W的非金属性比Y的强
B . 在该物质中Ⅹ原子满足8电子稳定结构
C . 该物质中含离子键和共价键
D . Z的氧化物都易溶于水中
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
|
族 周 期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
① |
② |
||||||
|
三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
|
四 |
⑨ |
⑩ |
-
(1) 在这些元素中,化学性质最不活泼的原子的原子结构示意图为
-
(2) ⑦的黄绿色单质的化学式为⑩的单质在常温下的存在状态为
-
(3) ①的气态氢化物的水溶液显性⑥的元素符号为
-
(4) 用电子式表示②与④形成化合物的过程
-
(5) 这些元素中的最高价氧化物对应的水化物中,碱性最强的是呈两性的是
-
(6) 写出⑤与盐酸反应的化学方程式:写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A . 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B . 核外电子排布相同的微粒化学性质也相同
C . Cl-、S2-、Ca2+、K+半径逐渐减小
D .  Cl与
Cl与  Cl得电子能力相同
Cl得电子能力相同
 Cl与
Cl与  Cl得电子能力相同
Cl得电子能力相同
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
-
(1) 氮原子价层电子对的轨道表达式(电子排布图)为。
-
(2) 元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是。
-
(3) 经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为,不同之处为。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为  ),则N5-中的大π键应表示为。
),则N5-中的大π键应表示为。③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、、。

-
(4) R的晶体密度为d g·cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:HAO4>H2BO4>H3CO4 , 则下列判断错误的是( )
A . 原子半径A>B>C
B . 气态氢化物稳定性HA>H2B>CH3
C . 非金属性A>B>C
D . 阴离子还原性C3->B2->A-
下列关于C、Si及其化合物结构与性质的论述错误的是( )
A . 键能 C-C>Si-Si、C-H>Si-H ,因此C2H6稳定性大于Si2H6
B . 立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度和熔点
C . 常温下C,Si的最高价氧化物晶体类型相同,性质相同。
D . Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 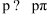 键
键
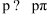 键
键
联合国大会宣布2019年是“国际化学元素周期表年”。下列说法错误的是( )
A . 短周期共有18种元素
B . 第三周期有8种原子
C . 元素周期表共有18个纵行
D . 在过渡元素中寻找各种优良的催化剂
下表列出了A~R9种元素在周期表中的位置:
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
|
2 |
E |
F |
||||||
|
3 |
A |
C |
D |
G |
R |
|||
|
4 |
B |
H |
-
(1) 在这9种元素中化学性质最不活泼的是_____A . E B . D C . R D . H
-
(2) A,B,C三种元素按原子半径由大到小的顺序排列为_____A . r(A)>r(B)>r(C) B . r(B)>r(A)>r(C) C . r(A)>r(C)>r(B) D . r(B)>r(C)>r(A)
-
(3) F元素氢化物在常温下跟A发生反应所得溶液的pH______7A . < B . > C . = D . 无法确定
-
(4) 在此周期表中,9种元素所形成的最高价氧化物对应的水化物,其中酸性最强和碱性最强的化学式是_____A . H2SO4 , NaOH B . H2SO4 , KOH C . HClO4 , NaOH D . HClO4 , KOH
-
(5) G元素和H元素两者核电荷数之差是_____A . 8 B . 10 C . 18 D . 26
-
(6) H元素和A元素形成化合物的化学式以及高温灼烧该化合物时,火焰颜色____A . NaBr 黄 B . NaCl 黄 C . KBr 紫 D . KCl 紫
将Na2O2、SiO2、KCl、Al、冰分别加热熔化,需要克服的作用力类型相同的物质有( )
A . 2种
B . 3种
C . 4种
D . 5种
下列表示正确的是(化学用语)( )
A . 中子数为18的氯原子:  B . 甲酸甲酯的最简式:
B . 甲酸甲酯的最简式:  C . 丙烷的球棍模型:
C . 丙烷的球棍模型: 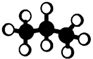 D . 氨基的电子式:
D . 氨基的电子式: 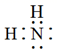
 B . 甲酸甲酯的最简式:
B . 甲酸甲酯的最简式:  C . 丙烷的球棍模型:
C . 丙烷的球棍模型:  D . 氨基的电子式:
D . 氨基的电子式: 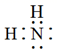
a、b、c、d、e、f、g、h八种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中b、c、d位于同一周期且相邻,e的原子半径是所有短周期主族元素中最大的.
请回答下列问题:
-
(1) a、d、e三种元素组成一种常见化合物,该化合物的电子式为,工业上利用某一个反应可同时生产该化合物和h的单质,写出该反应的化学方程式。
-
(2) c的单质分子
 中有3个共价键,f是一种重要的半导体材料,c与f能形成一种新型无机非金属材料X,则X的化学式为。
中有3个共价键,f是一种重要的半导体材料,c与f能形成一种新型无机非金属材料X,则X的化学式为。
-
(3) 在
 的密闭容器中,通入
的密闭容器中,通入  气体和
气体和 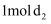 气体,一定温度下反应后生成
气体,一定温度下反应后生成 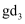 气体,当反应达到平衡时,d2的浓度为
气体,当反应达到平衡时,d2的浓度为 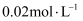 ,则平衡时
,则平衡时  的转化率为。
的转化率为。
-
(4) b的最简气态氢化物与h的气态单质在一定条件下发生反应,写出反应的化学方程式。
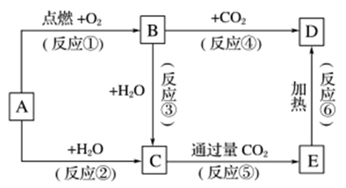
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
请填写下列空白:
-
(1) 写出B和C的电子式:B,C
-
(2) 以上反应中,属于非氧化还原反应的有(填序号)
-
(3) 写出反应④的化学方程式,该反应中B
a.是氧化剂 b.是还原剂 c.既是氧化剂又是还原剂 d.既非氧化剂又非还原剂
-
(4) 写出下列反应的离子方程式:
C+E—→D
E与足量Ba(OH)2溶液
B与FeSO4溶液
以SiC,AlN,ZnSe等宽禁带半导体材料为代表的第三代半导体材料是当前的研究热点。上述物质涉及的元素中属于主族元素的有( )
A . 5个
B . 4个
C . 3个
D . 2个
下列化学用语表示错误的是( )
A . 1-丁烯的分子式:C4H8
B . 醛基的结构简式:—CHO
C . 乙烯的电子式:  D . CCl4的球棍模型:
D . CCl4的球棍模型: 

已知铷和铯分别位于元素周期表第五周期ⅠA族和第六周期ⅠA族。下列说法不正确的是( )
A . 铯原子的最外层电子数是1
B . 铷比铯的金属性弱
C . 铯比铷的原子序数大32
D . 硝酸铯是离子化合物
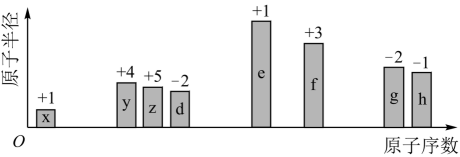
随原子序数递增,八种短周期元素(用字母x、y等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。回答下列问题:
-
(1) 写出由d、e两种元素组成的淡黄色化合物与水反应的离子方程式:。
-
(2) f在元素周期表中的位置位于。
-
(3) 写出f单质与e的最高价氧化物对应的水化物反应的离子方程式:。
-
(4) 写出y、z、d的最简单氢化物的稳定性由强到弱的顺序(用化学式表示)。
-
(5) 写出元素y用于测定文物年代的一种同位素的原子符号,该同位素形成的最高价氧化物69g中所含质子的数目为(用阿伏加德罗常数的值
 表示)。
表示)。
-
(6) 用电子式表示y的最高价氧化物的形成过程:。
-
(7) z的一种氢化物分子中既含非极性键又含极性键,其结构式为。
最近更新



