第一单元 化学反应速率与反应限度 知识点题库

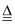 xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L.
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L.
-
(1) 从开始反应至达到平衡状态,生成C的平均反应速率为.
-
(2) x=.
-
(3) A的转化率与B的转化率之比为.
-
(4) 下列各项可作为该反应达到平衡状态的标志是 .A . 压强不再变化 B . 气体的平均相对分子质量不再变化 C . 气体密度不再变化 D . A的消耗速率与B的消耗速率之比为2:1.

①NaOH(固体)
②NaCl溶液
③HCl
④CH3COONa(固体)
N2(g)+3H2(g)  2NH3(g) △H<0反应中NH3的物质的量浓度的变化情况如图所示:
2NH3(g) △H<0反应中NH3的物质的量浓度的变化情况如图所示:

-
(1) 根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)=mol/(L·min)
-
(2) 反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_________(填字母序号)。A . 0 20 mol/L B . 0.1 mol/L C . 0.10 mol/L D . 0.08 mol/L
-
(3) 反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数(填“增大”、“减小”或“不变”).
-
(4) 在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25mol/L)。请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
 CO(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是 ( )
CO(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是 ( )


 B .
B . 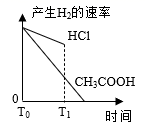 C .
C . 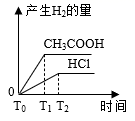 D .
D . 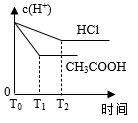
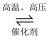 2NH3 , 经过一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol·L-1·s-1。则这段时间为( )
2NH3 , 经过一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol·L-1·s-1。则这段时间为( )
Ⅰ.丙烷氧化脱氢法: 
Ⅱ.丙烷无氧脱氢法: 

请回答下列问题:
-
(1) 已知

 ,由此计算
,由此计算 
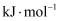 。
。
-
(2) 在催化剂作用下,
 氧化脱氢除生成
氧化脱氢除生成  外,还生成CO、
外,还生成CO、  等物质。
等物质。  的转化率和
的转化率和  的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。 
①图中
 的转化率随温度升高而上升的原因是。
的转化率随温度升高而上升的原因是。②在550℃时,
 的选择性为。(保留1位小数)(
的选择性为。(保留1位小数)(  的选择性
的选择性  )。
)。③
 的选择性:550℃575℃(填“大于”或“小于”)。
的选择性:550℃575℃(填“大于”或“小于”)。 -
(3) 某温度下,在刚性密闭容器中充入
 发生无氧脱氢制备丙烯。
发生无氧脱氢制备丙烯。 ①下列能说明该反应达到平衡状态的是。
a.

b.容器内气体的密度不再发生变化
c.容器内气体平均相对分子质量不再变化
d.容器内的压强不再发生变化
②若起始时容器内压强为
 ,反应达平衡后总压为
,反应达平衡后总压为  ,则
,则  的平衡转化率为,该反应的压强平衡常数
的平衡转化率为,该反应的压强平衡常数 
 (保留1位小数)。
(保留1位小数)。
该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) △H1=‒116 kJ/mol
-
(1) 已知:CO(g)+
 O2(g)=CO2(g) △H2= ‒283 kJ/mol
O2(g)=CO2(g) △H2= ‒283 kJ/mol H2(g)+
 O2(g)=H2O(g) △H3= ‒242kJ/mol
O2(g)=H2O(g) △H3= ‒242kJ/mol则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:。
-
(2) 下列措施中有利于增大该反应的反应速率的是_______(填字母代号)。A . 随时将CH3OH与反应混合物分离 B . 降低反应温度 C . 增大体系压强 D . 使用高效催化剂
-
(3) 在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。

请回答:
①在上述三种温度中,曲线Z对应的温度是;
②利用图中a点对应的数据,计算出曲线Z在对应温度下,反应CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=。
CH3OH(g)的平衡常数K=。 -
(4) 一氧化碳可将金属氧化物还原为金属单质和二氧化碳。四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时,lg
 与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是(填化学式)。
与温度(T)的关系如图。700℃时,其中最难被还原的金属氧化物是(填化学式)。 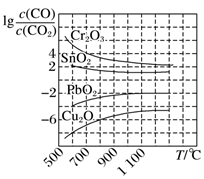
-
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为mol/L。
-
(1) 甲醇制取绿色能源氢气的部分反应过程如图1所示:

图1

图2
已知:Ⅰ.CH3OH(g)
 CO(g)+2H2(g)△H1=+90.4kJ•mol-1
CO(g)+2H2(g)△H1=+90.4kJ•mol-1Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g)△H2=-41kJ•mol-1
CO2(g)+H2(g)△H2=-41kJ•mol-1反应Ⅲ的热化学方程为。
-
(2) 在恒压密闭容器中,反应Ⅱ的进气比
 同时,测得相应的CO的平衡转化率如图2所示(各点对应的反应条件除温度可能不同外,其余都相同)
同时,测得相应的CO的平衡转化率如图2所示(各点对应的反应条件除温度可能不同外,其余都相同) ①图中A、D和F三点对应的反应温度TA、TD、TF的关系是,其原因是。
②CO的平衡转化率与进气比、反应温度之间的关系是。
③C、D两点对应的反应速率大小:vCvD(填“>”“<”或“=”)。
已知反应速率v=v正-v逆=k正•x(CO)•x(H2O)-k逆•x(CO2)•x(H2),其中k为反应速率常数、x为物质的量分数,在达到平衡状态为D点的反应过程中,当CO的转化率刚好达到20%时,
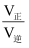 =(结果保留3位有效数字)。
=(结果保留3位有效数字)。
-
(1) Ⅰ.在特定环境中有效地处理CO2具有重要的研究价值。CO2的转化途径之一为:
CO2 (g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0请回答:
上述反应自发进行的条件为(“高温”“任意温度”或“低温”)。
-
(2) 某实验小组对该反应进行了如下探究:向Ⅰ、Ⅱ、Ⅲ三个容积均为2 L的相同的恒容密闭容器中分别投入1mol CO2、3 mol H2 , 同时在Ⅰ、Ⅱ、Ⅲ三个容器中分别加入等量的催化剂A、催化剂B和催化剂C,控制反应的温度,让其发生反应。测定在相同时间内CO2的转化率随温度的变化曲线如图所示:

①催化剂对反应的催化效果由强到弱的顺序为>> (选填A、B、C序号);
②b点时v (正)v(逆) (填“>”“<””或“=”);
③图中a、c点均表示反应已经达平衡状态,a点CO2的平衡转化率比c点高的原因是;
④T4 K时,此反应的平衡常数K=(结果保留两位小数)。
Ⅱ.甲醇可以通过MTP工艺制丙烯:
该工艺的主反应为:3CH3OH(g)
 C3H6(g)+3H2O(g) ΔH=-98.1 kJ·mol-1.此外还存在多个副反应。已知:①主反应与副反应(消耗CH3OH)都为放热反应;
C3H6(g)+3H2O(g) ΔH=-98.1 kJ·mol-1.此外还存在多个副反应。已知:①主反应与副反应(消耗CH3OH)都为放热反应;②催化剂选择性最佳温度为460℃。
在2 L恒容密闭容器中,充入2 mol甲醇(g),控制反应温度始终为460℃,t1时刻反应恰好达到平衡,此时甲醇(g)的平衡转化率为75%,发生主反应的选择性为40%,请在下图中画出0~t2时刻丙烯浓度随时间的变化图象。

 , 已知
, 已知 、
、 、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1 , 当反应达到平衡时,各物质的浓度不可能是( )
、Z的起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1 , 当反应达到平衡时,各物质的浓度不可能是( )
 mol·L-1
B .
mol·L-1
B .  mol·L-1
C .
mol·L-1
C .  mol·L-1
D .
mol·L-1
D .  mol·L-1
mol·L-1
-
(1) H2O分子用电子式表示为。该反应中每生成0.5 mol甲醇,转移电子的物质的量是mol。
-
(2) 一定条件下,该反应过程中的能量变化情况如图所示,图中E2-E1 =kJ·mol−1。

-
(3) T1℃下,向一容积为3 L的恒容密闭容器中加入一定量的CO2和H2 , 在催化剂存在时发生反应:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:
CH3OH(g) + H2O(g),测得不同时间(t)各物质的物质的量如下表:t / min
n(CO2) / mol
n(H2) / mol
n(CH3OH) / mol
n(H2O) / mol
0
2.00
6.00
0
0
t1
1.65
a
0.35
0.35
t2
b
3.60
0.80
0.80
t3
b
3.60
0.80
0.80
①0 ~ t1 min内,用H2浓度变化表示该反应的化学反应速率为mol·L−1·min−1。
②下列有关上述反应的说法正确的是(填序号)
A.CH3OH中的化学键是共价键
B.消耗3 mol H2(g)的同时生成1 mol H2O(g),此时该反应达到化学平衡
C.0 ~ t1 min内反应放出的热小于t1~ t2 min内放出的热
-
(4) 甲醇(CH3OH)燃料电池的电极采用膜电极,该电极由催化剂层和质子交换膜构成,其中质子交换膜能传导H+ , 同时作为隔膜防止两极的物质相互反应。该电池的工作原理如图:

①该电池的负极是。(填“电极a”或“电极b”)
②工作时,电极b的电极反应式是。



