第二单元 化学反应中的热 知识点题库
(1)2克乙炔完全燃烧生成液态水和CO2 , 放出99.6KJ热量.则乙炔的燃烧热△H= ,2摩尔乙炔完全燃烧放出的热量是 .
(2)写出乙二酸与乙二醇反应生成六元环状酯的方程式 (不必写反应条件)
(3)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L﹣1 | c(H2SO4)/mol•L﹣1 |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.1 | 0.2 |
③ | 50 | 0.2 | 0.1 |
④ | 50 | 0.1 | 0.1 |
其他条件不变时:探究浓度对化学反应速率的影响,应选择 (填实验编号);探究温度对化学反应速率的影响,应选择 (填实验编号).写出该反应的离子方程式: .
下列图示与对应的叙述不相符合的是( ) 
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C﹣F | 427 | C﹣Cl | 330 | C﹣I | 218 |
H﹣H | 436 | S=S | 255 | H﹣S | 339 |
回答下列问题:
-
(1) 由表中数据规律预测C﹣Br键的键能范围:<C﹣Br键能<(回答数值和单位).
-
(2) 热化学方程式2H2(g)+S2(g)═2H2S(g);△H=Q kJ•mol﹣1;则Q=.
-
(3) 已知下列热化学方程式:
O2(g)═O+2(g)+e﹣△H1=+1175.7kJ•mol﹣1
PtF6(g)+e﹣═PtF6﹣(g)△H2=﹣771.1kJ•mol﹣1
O2+PtF6﹣(s)═O2+(g)+PtF6﹣(g)△H3=+482.2kJ•mol﹣1
则反应O2(g)+(g)=O2+PtF6﹣(s)△H= kJ•mol﹣1 .
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ 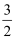 O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
根据上面三个热化学方程式,回答下列问题:
-
(1) CO的燃烧热为;写出其热化学方程式.
-
(2) 高炉内Fe2O3被CO还原为Fe的热化学方程式为.
-
(3) 炼制1t(吨)含铁96%的生铁所需焦炭的理论用量是 t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是.
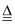 2CO
2CO
-
(1) 已知:①CO(g) + 2H2(g)
 CH3OH(l) ΔH=-128.1 kJ·mol-1
CH3OH(l) ΔH=-128.1 kJ·mol-1②2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1
③H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
④2CO(g) + O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1
写出表示CH3OH燃烧热的热化学方程式:。
-
(2) 不同温度下,将1.0 molCH4和2.4molH2O(g)通入容积为10 L的恒容密闭容器中发生如下反应: CH4(g)+ H2O(g)
 CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示: 
①T1T2(填“>”“<”或“=”,下同),其对应的平衡常数K1K2。
②温度T2下,从反应开始到2min时,ν(H2O)=。
③T1温度时,若已知到达平衡是H2O(g)的体积百分含量为40%,则该温度下上述反应的平衡常数K=。(保留两位小数点)
-
(3) 科学家用氮化镓组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成了CH4。铜电极表面的电极反应式为。

-
(4) 已知CO可与I2O5反应:5 CO(g)+I2O5(s)
 5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。 ①滴定终点时溶液颜色变化为。
②气体样品中CO的体积分数为。
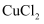 固体加水溶解后,以石墨为电极电解该溶液。上述变化过程中会放出热量的是()
固体加水溶解后,以石墨为电极电解该溶液。上述变化过程中会放出热量的是()
-
(1) 用H2O2和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) △H=64kJ/mol;2H2O2(l)=2H2O(l)+O2(g) △H= -196kJ/mol;H2(g)+1/2O2(g)=H2O(l) △H= -286kJ/mol.在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为。
-
(2) 控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(℃)
20
30
40
50
60
70
80
铜平均溶解速率×10-3mol.L-1.min-1
7.34
8.01
9.25
7.98
7.24
6.73
5.76
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是。
-
(3) 在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是。
-
(1) 已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔH= kJ·mol-1。
-
(2) 催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO
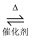 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示: 
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是。
-
(3) NO氧化反应:2NO(g)+O2(g)⇌2NO2(g)分两步进行,其反应过程能量变化示意图如图:

Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:。

-
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:

研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:。

-
(1) 在101kPa时,
 在
在 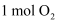 中完全燃烧生成2mol液态水,放出
中完全燃烧生成2mol液态水,放出  的热量,请写出
的热量,请写出  燃烧热的热化学方程式为 。
燃烧热的热化学方程式为 。
-
(2) 已知1g碳粉在氧气中完全燃烧放出的热量是
 ,试写出相关的热化学方程式。
,试写出相关的热化学方程式。
-
(3) 已知在常温常压下:
①

②

③

写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
-
(4) 将
 和
和  充入2L盛有催化剂的密闭容器中,发生氨的催化氧化。如图为不同温度下,反应5min时NO的产率图。
充入2L盛有催化剂的密闭容器中,发生氨的催化氧化。如图为不同温度下,反应5min时NO的产率图。 
①
 下,5min内该反应的平均反应速率
下,5min内该反应的平均反应速率 
②若不考虑催化剂的影响,5min时
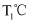 下和
下和  下逆反应速率较快的为
下逆反应速率较快的为  填“
填“ 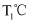 ”或“
”或“  ”
”  ,原因为
,原因为
 CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是( )
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2 , 测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是( ) 
 B .
B .  C .
C .  D .
D . 
H+(aq)+ OH-(aq) → H2O (l) +57.3kJ
向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应Q1、Q2、Q3的关系正确的是( )
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
其相对能量与反应历程如下图所示,下列说法错误的是( )

 CO2+N2
B . 在反应过程中,有极性键和非极性键的断裂和生成
C . 总反应的反应速率由第一步反应决定
D . Fe*为反应的催化剂,FeO*为中间产物
CO2+N2
B . 在反应过程中,有极性键和非极性键的断裂和生成
C . 总反应的反应速率由第一步反应决定
D . Fe*为反应的催化剂,FeO*为中间产物
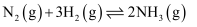
 , 则
, 则 的焓变为( )
的焓变为( )



