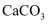第二单元 重要的含氮化工原料 知识点题库
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2⇌N2O4).
-
(1) 硝酸在该反应中体现的性质有.
-
(2) 如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式.
-
(3) 0.004molCu被硝酸完全溶解后,Cu失去的电子数是,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为 mL;所得溶液(假设溶质不扩散)的物质的量浓度是.
类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )
A . SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B . 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
C . SO2能使品红溶液褪色,故CO2也能使品红溶液褪色
D . 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
某课外实验小组设计的如图实验合理的是( )
A .  配制一定浓度硫酸溶液
B .
配制一定浓度硫酸溶液
B .  制备少量氨气
C .
制备少量氨气
C .  制备并收集少量NO2气体
D .
制备并收集少量NO2气体
D .  制备少量氧气
制备少量氧气
 配制一定浓度硫酸溶液
B .
配制一定浓度硫酸溶液
B .  制备少量氨气
C .
制备少量氨气
C .  制备并收集少量NO2气体
D .
制备并收集少量NO2气体
D .  制备少量氧气
制备少量氧气
下列因果关系叙述正确的是( )
A . 浓硝酸中的HNO3见光会分解,因此有时在实验室看到的浓硝酸呈黄色
B . SO2具有漂白性,因此可使溴水褪色
C . Na的金属性比Cu强,因此可用Na与CuSO4溶液反应制取Cu
D . Fe在Cl2中燃烧生成FeCl3 , 因此在与其他非金属反应的产物中Fe也显+3价
要鉴别浓H2SO4和浓HNO3两种溶液,不能选用的试剂是( )
A . BaCl2溶液
B . 蔗糖
C . 铜片
D . Al2O3粉末
A、B、C、D都是核外电子总数为10的微粒。
-
(1) A为中性微粒。如果A能刻蚀玻璃,则A是(填化学式,下同);如果A的水溶液显碱性,则A是。
-
(2) B是带电微粒。如果B为阳离子且其水溶液能使紫色石蕊溶液变红,则B是;如果B为阴离子且其水溶液能使无色酚酞溶液变红,则B是。
-
(3) 若1个C微粒中含有5个原子,带正电荷,遇碱放出NH3 , 则C是。
-
(4) 若D微粒遇阴离子B,先生成沉淀,后沉淀溶解,则D是。
取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份。其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入到500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L。已知Cu2O+2H+=Cu+Cu2++H2O。则稀硝酸的浓度为( )
A . 2 mol/L-1
B . 1.6 mol/L-1
C . 0.8 mol/L-1
D . 0.4 mol/L-1
下列关于硝酸的叙述正确的是( )
A . NO2溶于水生成硝酸,所以NO2是酸性氧化物
B . 硝酸可与活泼金属反应生成盐和氢气
C . 常温下铁与浓硝酸反应,产生大量的红棕色气体
D . 硝酸与铜的反应既表现出氧化性又表现出酸性
等质量的下列物质与足量稀硝酸反应,放出NO的物质的量最多的是( )
A . Fe
B . FeO
C . Fe2O3
D . Fe3O4
某同学比较了Cu和浓硝酸与稀硝酸反应后的还原产物不同,说明浓硝酸的氧化性强于稀硝酸。该同学认为浓硝酸能把NO氧化为NO2 , 同学们讨论后设计了实验验证了NO能被浓硝酸氧化,同学们组装了如右所示装置验证以上结论,完成下列问题:

-
(1) M仪器的名称是
-
(2) 写出甲中反应的离子方程式:;
-
(3) 各装置按甲、乙、丙连接,则:a 接、接、;
-
(4) 在实验之前通入N2的目的是:;
-
(5) 乙中观察到的现象是:;乙中反应的化学方程式为:;
-
(6) 写出丙中两种气体按1:1反应的离子方程式。
硝酸铜受热分解产生的气体能使带火星的木条复燃,其原因是。
下列关于浓HNO3和浓H2SO4的叙述中正确的是( )
A . 常温下都不能用铝制容器贮存
B . 露置在空气中,容器内酸液的浓度都降低
C . 常温下都能与铜较快反应
D . 滴在紫色石蕊试纸上,试纸都只变红
下表中,陈述Ⅰ、Ⅱ均符合题意且二者间具有因果关系的是( )
A . A
B . B
C . C
D . D
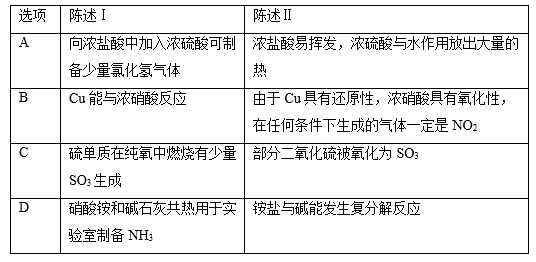
实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨气),下列说法错误的是( )
A . 装置①、②、⑤依次盛装碱石灰、无水CaCl2、NaOH溶液
B . 装置③中气体呈红棕色
C . 装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D . 通空气的主要作用是鼓出氨气,空气可用N2代替
对下列事实的解释错误的是( )
A . 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B . 浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定
C . 常温下浓硫酸、浓硝酸可以用铝罐贮存,说明浓硫酸、浓硝酸与铝不反应
D . 反应CuSO4+H2S=CuS↓+H2SO4说明硫化铜既不溶于水,也不溶于稀硫酸
请回答下列问题:
-
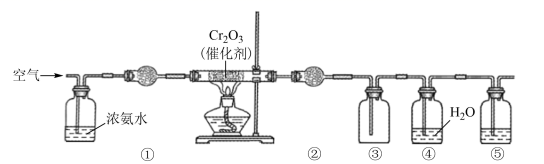
(1) 现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。
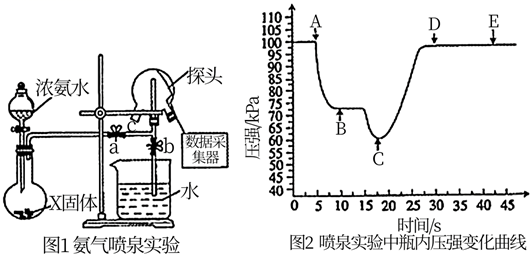 制取氨气时烧瓶中的X固体常用(写一种)。关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈瓶内压强变化曲线如图2,则点时喷泉最剧烈,理由是。
制取氨气时烧瓶中的X固体常用(写一种)。关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈瓶内压强变化曲线如图2,则点时喷泉最剧烈,理由是。 -
(2) 用消石灰和氯化铵固体制备NH3
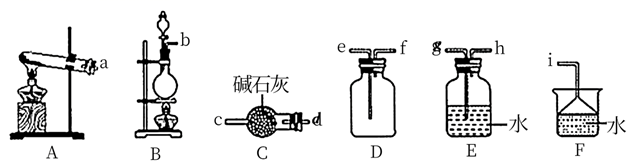 NH3的发生装置应选择上图中的(填大写字母代号),制备NH3的化学方程式为;欲收集一瓶干燥的NH3 , 选择上图的装置,其连接顺序为:发生装置→。(按气流方向,用小写字母表示)。
NH3的发生装置应选择上图中的(填大写字母代号),制备NH3的化学方程式为;欲收集一瓶干燥的NH3 , 选择上图的装置,其连接顺序为:发生装置→。(按气流方向,用小写字母表示)。 -
(3) 设计了下图所示的实验装置模拟工业生产制备少量硝酸。
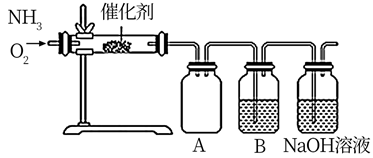
①实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是(填“吸热”或“放热”)反应,B中试剂为,NaOH溶液的作用是;
②控制氨气和氧气的比例是制备硝酸的关键。
当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是;欲使氨气尽可能完全转化为硝酸,理论上
 的最佳比例为。
的最佳比例为。
无色的混合气体甲,可能含有NO、  、
、  、
、  、
、  中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )
中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )
 、
、  、
、  、
、  中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )
中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( ) 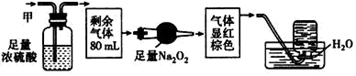
A .  、
、  、
、  B .
B .  、
、  、
、  C .
C .  、NO、
、NO、  D . NO、
D . NO、  、
、 
 、
、  、
、  B .
B .  、
、  、
、  C .
C .  、NO、
、NO、  D . NO、
D . NO、  、
、 
对下列事实的解释错误的是( )
A . 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B . 常温下,浓硝酸可以用铁制器皿贮存,说明铁与浓硝酸不反应
C . 氯水和SO2使品红溶液褪色的原理不同
D . 漂白粉在空气中久置变质,是因为漂白粉中的Ca(ClO)2与空气中的CO2、H2O发生反应
下列方案设计、现象和结论都正确的是( )
目的 | 方案设计 | 现象和结论 | |
A | 验证 | 取样与适量溴水混合,充分反应,观察现象 | 溴水褪色,说明样品分子中含有碳碳双键 |
B | 检验淀粉水解是否完全 | 将适量样品与稀硫酸反应,加入足量 | 无明显现象,说明淀粉水解完全 |
C | 检验牙膏中的摩擦剂成分 | 取少量牙膏于试管中,加水溶解,滤渣中滴加足量盐酸 | 若滤渣溶解并产生无色气泡,则摩擦剂可能为 |
D | 检验某固体是否为铵盐 | 取样品于试管中,滴加少量 | 若试纸不变蓝色,则固体不是铵盐 |
A . A
B . B
C . C
D . D
下列叙述正确的是( )
A . 氨水和液氨不同,氨水是混合物,液氨是纯净物
B . 氨水浓度越大,密度也越大
C . 氨气与氯化氢气体相遇产生白色烟雾
D . 在反应NH3+H+=NH  中,NH3失去电子被氧化
中,NH3失去电子被氧化
 中,NH3失去电子被氧化
中,NH3失去电子被氧化
最近更新
 分子中的碳碳双键
分子中的碳碳双键 溶液后加入碘水,观察现象
溶液后加入碘水,观察现象