第一单元 金属的冶炼方法 知识点题库
欲迅速除去水壶底部的水垢,又不损坏铝壶,最好的方法是用 ( )
A . 浓盐酸
B . 稀硝酸
C . 冷的浓硫酸
D . 冷的浓硝酸
下列实验的操作和结论正确的是( )
A . 将0.1mol Na和少量Al片放入水溶液中,放出气体刚好是0.05 mol
B . Na2O2投入到FeCl2溶液中只得到大量白色沉淀
C . 镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉
D . 配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大
某化学兴趣小组用回收的镁铝合金制取氢气。现有10.8g镁铝合金,下列说法正确的是( )
A . 常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6molH2
B . 常温下与足量2mol/LHNO3溶液反应,最少可放出0.45molH2
C . 常温下与足量2mol/LH2SO4溶液反应,放出H2的物质的量在0.45~0.6mol之间
D . 常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0.45~0.6mol之间
请根据题意选择下列物质:
A.明矾[KAI(SO4)2•12H2O]B.Fe2O3
C.NaHCO3 D.熟石灰[Ca(OH)2],
并用其字母代号填空:
(1)一种红棕色粉末,常用作红色油漆和涂料的是
(2)要使含泥沙的洪水变澄清,可使用 ;
(3)要中和钢铁厂、电镀厂产生的酸性废水,可使用 ;
(4)使焙制糕点松软可以添加 .
实验室需要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜的试剂是( )
A . NaOH溶液
B . 氨水
C . 盐酸
D . Ba(OH)2溶液
由MgO、Al2O3、SiO2、Fe2O3组成的混合粉末.现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
A . 从组成看,其成分皆是碱性氧化物
B . 溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+
C . 沉淀X的成分是SiO2
D . 在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
下列曲线图(纵坐标为沉淀的物质的量,横坐标为加入物的量)不正确的是( )
A .  向1 L浓度均为0.1 mol•L﹣1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L﹣1稀硫酸
B .
向1 L浓度均为0.1 mol•L﹣1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L﹣1稀硫酸
B .  向1 L含有0.1 mol•L﹣1 AlCl3和0.3 mol•L﹣1 NH4Cl的混合液中加入0.1 mol•L﹣1 NaOH溶液
C .
向1 L含有0.1 mol•L﹣1 AlCl3和0.3 mol•L﹣1 NH4Cl的混合液中加入0.1 mol•L﹣1 NaOH溶液
C .  向烧碱溶液滴加明矾溶液
D .
向烧碱溶液滴加明矾溶液
D .  向AlCl3溶液滴加过量氨水
向AlCl3溶液滴加过量氨水
 向1 L浓度均为0.1 mol•L﹣1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L﹣1稀硫酸
B .
向1 L浓度均为0.1 mol•L﹣1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L﹣1稀硫酸
B .  向1 L含有0.1 mol•L﹣1 AlCl3和0.3 mol•L﹣1 NH4Cl的混合液中加入0.1 mol•L﹣1 NaOH溶液
C .
向1 L含有0.1 mol•L﹣1 AlCl3和0.3 mol•L﹣1 NH4Cl的混合液中加入0.1 mol•L﹣1 NaOH溶液
C .  向烧碱溶液滴加明矾溶液
D .
向烧碱溶液滴加明矾溶液
D .  向AlCl3溶液滴加过量氨水
向AlCl3溶液滴加过量氨水
下列金属:①铁 ②镁 ③锰 ④钒 ⑤铬,可用铝热法制备的有( )
A . ①②④
B . ①②③⑤
C . ①③④⑤
D . ①②③④⑤
下列关于铝及其化合物的说法中,不正确的是( )
A . 铝制餐具适宜用来长时间存放酸性、碱性或咸的食物
B . 铝是地壳中储量最丰富的金属元素,在自然界中以化合态形式存在
C . 由于铝易生成致密的氧化物薄膜保护内层金属,铝制品在生活中被广泛使用
D . 在盛有浑浊泥水的试管中加入少量明矾,充分振荡后静置,上层液体变澄清
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
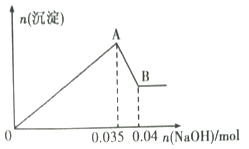
根据上述实验和图中数据:
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。

根据上述实验和图中数据:
-
(1) 该废水中一定不含有的离子有(填离子符号);
-
(2) 写出A→B 过程中发生反应的离子方程式:;
-
(3) 该废水中,c(Al3+)=;
-
(4) ①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
下列有关厨房中铝制品使用合理的是( )
A . 盛放食醋
B . 用碱水洗涤
C . 烧煮开水
D . 用金属丝擦洗表面的污垢
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )

| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A . A
B . B
C . C
D . D
下列指定反应的离子方程式正确的是( )
A . 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
B . 用铝粉和NaOH溶液反应制取少量H2:Al+2OH−=  +H2↑
C . 室温下用稀HNO3溶解铜:Cu+2
+H2↑
C . 室温下用稀HNO3溶解铜:Cu+2  +2H+=Cu2++2NO2↑+H2O
D . NaHCO3溶液与足量的NaOH溶液混合:
+2H+=Cu2++2NO2↑+H2O
D . NaHCO3溶液与足量的NaOH溶液混合:  +OH-=
+OH-=  +H2O
+H2O
 +H2↑
C . 室温下用稀HNO3溶解铜:Cu+2
+H2↑
C . 室温下用稀HNO3溶解铜:Cu+2  +2H+=Cu2++2NO2↑+H2O
D . NaHCO3溶液与足量的NaOH溶液混合:
+2H+=Cu2++2NO2↑+H2O
D . NaHCO3溶液与足量的NaOH溶液混合:  +OH-=
+OH-=  +H2O
+H2O
下列“解释或结论” 正确的是( )
| 选项 | 实验操作及现象 | 解释或结论 |
| A | 将氯水滴入碘化钾淀粉溶液中,溶液变成蓝色 | Cl2的氧化性强于I2 |
| B | 切开一小块金属钠,钠表面很快变暗 | 钠在空气中会生成Na2O2 |
| C | 向某钠盐溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该盐一定是Na2CO3 |
| D | 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,铝熔化但不滴落 | Al的熔点高于Al2O3 |
A . A
B . B
C . C
D . D
下列有关电解的叙述正确的是( )
A . 工业上用电解熔融  的方法制取
的方法制取 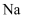 时,阳极材料可以是石墨或铁
B . 可以用电解熔融的
时,阳极材料可以是石墨或铁
B . 可以用电解熔融的 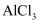 来制取
来制取 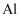 C . 工业上电解饱和食盐水制备烧碱,采用阳离子交换膜
D . 电解精炼铜时,溶液中铜离子的浓度不变
C . 工业上电解饱和食盐水制备烧碱,采用阳离子交换膜
D . 电解精炼铜时,溶液中铜离子的浓度不变
 的方法制取
的方法制取 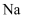 时,阳极材料可以是石墨或铁
B . 可以用电解熔融的
时,阳极材料可以是石墨或铁
B . 可以用电解熔融的 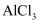 来制取
来制取  C . 工业上电解饱和食盐水制备烧碱,采用阳离子交换膜
D . 电解精炼铜时,溶液中铜离子的浓度不变
C . 工业上电解饱和食盐水制备烧碱,采用阳离子交换膜
D . 电解精炼铜时,溶液中铜离子的浓度不变
下列有关物质的性质与用途具有对应关系的是( )
A . 钠钾合金的密度小,可用作快中子反应堆的热交换剂
B . Al2O3 的熔点很高,可用作耐火材料
C . Na2SiO3 溶液呈碱性,可用作木材的防火剂
D . FeCl3 溶液具有酸性,可用作铜制线路板的蚀刻剂
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A . 氢氧化钠与盐酸;氢氧化钠与碳酸
B . Al2O3与硫酸反应;Al2O3与盐酸
C . Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D . BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
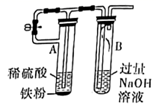
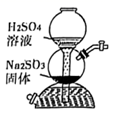
下列实验(略去部分夹持仪器)能达到实验目的的是。( )
| | | | |
| A.铝热反应 | B.制备 | C.制备 | D.测定 |
A . A
B . B
C . C
D . D
下列物质中,既能跟盐酸反应又能跟NaOH溶液反应的是( )
A . CO2
B . MgO
C . Al2O3
D . Fe2O3
下列说法不正确的是( )
A . 常温下钠和钾的合金呈液态,可用作快中子反应堆的导热剂
B . 铁粉和氧化铝可用于焊接铁轨
C . 硫酸可用于金属材料表面的清洗
D . 极少量的 能促进血管扩张,防止栓塞
能促进血管扩张,防止栓塞
 能促进血管扩张,防止栓塞
能促进血管扩张,防止栓塞
最近更新


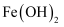 沉淀
沉淀 气体
气体 溶液的浓度
溶液的浓度


