第三单元 物质结构研究的意义 知识点题库
泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍.当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000只紫蜗牛,现知其结构为如下图所示的含溴有机化合物,下列说法不正确的是 ( )

W | X | Y | Z | |
结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
-
(1) Z在元素周期表中位于 族
-
(2) 上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是 (填元素符号).
-
(3) ①下列可作为比较X和Y金属性强弱的依据是 (填序号).
a.自然界中的含量 b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y.
-
(4) W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是 ,混合后溶液中离子浓度由大到小的顺序是
-
(5)
Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有 (填序号).
a.m、n b.m、y c.n、y.
如图是部分短周期元素原子半径与原子序数的关系图.下列说法正确的是( )

 ;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族.
-
(1) 写出元素符号:X,Y,Z,W.
-
(2) Z、W两元素最高价氧化物对应水化物反应的方程式是.
-
(3) 把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是,反应的化学方程式是.
-
(1) 基态溴原子的核外电子排布式为[Ar]。
-
(2) 在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是。
-
(3) HIO3的酸性(填“强于”或“弱于”) HIO4 , 原因是。
-
(4) ClO2-中心氯原子的杂化类型为,ClO3-的空间构型为。
-
(5) 晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(
 ,
,  ,0);C处为(1,1,1)。则D处微粒的坐标参数为。
,0);C处为(1,1,1)。则D处微粒的坐标参数为。 

②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3 , 则晶胞中Ca2+与离它最近的F-之间的距离为nm (设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。
-
(1) 写出上述制备硅的化学反应方程式。
-
(2) 二氧化硅与二氧化碳物理性质差别很大,原因是。
-
(3) 盐X的溶液能与Al2(SO4)3溶液反应生成一种白色沉淀和气体。写出此反应的离子反应方程式。
-
(4) Ⅱ、某盐A有3种元素组成,易溶于水。将A加热,生成既不助燃,也不使湿润的红色或蓝色石蕊试纸变色的气体B和H2O。将A溶于水,进行下列实验:①酸性条件下与H2S作用生成淡黄色沉淀C,同时放出无色气体D,D在空气中转变为红棕色气体E;②当通入足量Cl2时,无明显现象,但将所得溶液浓缩后即可得到无色晶体盐F。请回答下列问题:
写出A的化学式:; B的电子式:。
-
(5) 写出上述实验①、②所发生的离子反应方程式:①;②。
-
(6) D、E对环境有危害,可用NaOH溶液来吸收等物质的量的D、E混合气体,写出其化学反应方程式。
-
(7) 判断盐F的可能成分;设计实验方案确定F的成分。

2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料
Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发
射的设计和应用提供一个新的有效策略。
-
(1) 基态Sn原子价层电子的空间运动状态有种,基态氧原子的价层电子排布式不能表示为
 ,因为这违背了原理(规则)。
,因为这违背了原理(规则)。
-
(2) [B(OH)4] -中氧原子的杂化轨道类型为,[B(OH)4] -的空间构型为。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是。
a.
 键 b.σ键 c.配位键 d.极性键
键 b.σ键 c.配位键 d.极性键 -
(3) 碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是(填化学式),其原因是。
-
(4) 超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为。已知阿伏加德罗常数的值为NA , 若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为g·cm-3(列出含a、NA的计算式即可)。
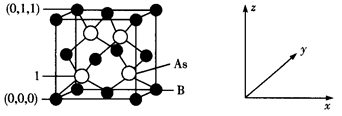
-
(1) 比较结合H+能力的相对强弱:H2O(填“>”“<”或“=”)NH3;用一个化学方程式说明H2O和NH3结合H+能力的相对强弱:。
-
(2) NaNH2是离子化合物,各原子均满足8电子或2电子稳定结构。写出NaNH2的电子式:。
-
(3) 异丁烷的沸点低于正丁烷,原因是。

-
(1) 基态P原子中,电子占据的最高能级符号为,基态N原子核外有种运动状态不同的电子。
-
(2) C、N、O三种元素电负性从大到小的顺序为;第一电离能χ(P)χ(Cl)(填“>”或“<”)。
-
(3) 磷酸氯喹中N原子的杂化方式为,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是。
-
(4) GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体碳化硅类似,熔点如表所示,
GaN
GaP
GaAs
熔点/℃
1700
1480
1238
①GaN、GaP、GaAs的熔点变化原因是。
②砷化镓晶体中含有的化学键类型为(填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为;若磷化镓的晶体密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中Ga和P原子的最近距离为pm(用代数式表示)。

 O
O
 , 虽然其数量有限,但它是已知气体中吸热最高的气体。关于
, 虽然其数量有限,但它是已知气体中吸热最高的气体。关于 的说法正确的是( )
的说法正确的是( )
 中最多有4个原子在一条直线上
B .
中最多有4个原子在一条直线上
B .  易燃烧生成
易燃烧生成 、
、 C .
C .  分子是含有极性键的极性分子
D .
分子是含有极性键的极性分子
D .  中硫元素的化合价为
中硫元素的化合价为 价
价
-
(1) X、Y、W的第一电离能由大到小的顺序是 (填字母对应的元素符号)。
-
(2) 已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为 (元素Z用对应的元素符号书写)。
-
(3) 已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为
 )形式存在的原因是。
)形式存在的原因是。X—X
X≡X
Z—Z
Z≡Z
193
946
197
489
-
(4) 元素W的含氧酸根离子(WO
 )的空间构型为,与之互为等电子体的阴离子有 (写出一种离子符号;等电子体指化学通式相同且价电子总数相等的分子或离子)。
)的空间构型为,与之互为等电子体的阴离子有 (写出一种离子符号;等电子体指化学通式相同且价电子总数相等的分子或离子)。
-
(5) 对于基态Q原子,下列叙述正确的是____ (填标号)。A . 遵循能量最低原理,核外电子排布应为[Ar]3d94s2 B . 排布在外层的电子总是比排布在内层的电子离核更远 C . 电负性比钾高,原子对键合电子的吸引力比钾大 D . 电子先排入4s轨道,再排进3d轨道,故3d轨道的电子能量比4s高
-
(6) 向盛有QSO4水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。分离出所得溶质化合物[Q(NH3)4(H2O)2]SO4 , 然后加热该化合物固体,首先失去的组分是,理由是。



