专题2 原子结构与元素性质 知识点题库
某主族元素的原子最外层电子排布是5s1 , 下列描述中正确的是( )
A . 其单质常温下跟水反应不如钠剧烈
B . 其原子半径比钾原子半径小
C . 其碳酸盐易溶于水
D . 其氢氧化物不能使氢氧化铝溶解
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
-
(1) Ni2+基态核外电子排布式为.
-
(2) ClO4﹣的空间构型是;与ClO4﹣互为等电子体的一种分子为(填化学式).
-
(3) 化学式中CHZ为碳酰肼,组成为CO(N2H3)2 , 碳酰肼中碳原子的杂化轨道类型为;1molCO(N2H3)2分子中含有σ键数目为.
-
(4) 高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成.NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a:b:c=.

关于原子轨道的说法正确的是( )
A . 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B . CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C . 乙炔分子中,两个碳原子均采用sp2杂化轨道成键
D . sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相等的新轨道
X、Y两元素可形成X2Y3型离子化合物,则X、Y原子基态时最外层的电子排布可能是( )
A . X:3s23p1 Y:3s23p5
B . X:2s22p3 Y:2s22p4
C . X:3s23p1 Y:2s22p4
D . X:3s2 Y:2s22p3
下列说法正确的是( )
A . 原子最外层电子数等于或大于4的元素一定是非金属元素
B . 原子最外层只有2个电子的元素一定是金属元素
C . 最外层电子数比次外层电子数多的元素一定位于第二周期
D . 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
下列分子中,中心原子的杂化轨道类型相同,空间构型也相同的是( )
A . BeCl2 CO2
B . H2O SO2
C . BF3 NCl3
D . SiCl4 SO3
下表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是( )
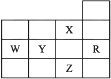
A . W元素的第一电离能小于Y元素的第一电离能
B . Y、Z的阴离子电子层结构都与R原子的相同
C . p能级未成对电子最多的是Z元素
D . X元素是电负性最大的元素
下列各组指定的元素,不能形成AB2型化合物的是( )
A . 2s22p2和2s22p4
B . 2s22p2和3s23p4
C . 3s2和3s23p5
D . 3s1和3s23p5
X、Y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子的电子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是( )
A . Z2X
B . Z2Y
C . W2X
D . W2Y
下列叙述正确的是( )
①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用于制作红色油漆和涂料
③碳酸氢钠俗名小苏打,可用于制作发酵粉和治疗胃酸过多的药物
④过氧化钠比氧化钠稳定,两种氧化物均可作潜艇中的供氧剂
⑤焰色反应体现的是某些金属元素的物理性质
A . ①②③⑤
B . ②③④⑤
C . ①③④⑤
D . ①②③④
下列表达式正确的是( )
A . 基态铬原子Cr的价电子排布式:3d44s2
B . 氮原子的L层电子轨道表示式:  C . K+的结构示意图:
C . K+的结构示意图: 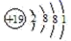 D . HClO的电子式:
D . HClO的电子式: 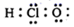
下列说法正确的是( )
A . CHCl3是三角锥形
B . H2O分子中氧原子为sp2杂化。其分子几何构型为V型
C . 二氧化碳中碳原子为sp杂化,为直线型分子
D .  是平面四边形结构
是平面四边形结构
 是平面四边形结构
是平面四边形结构
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。下列有关说法正确的是( )
A . F−的半径比O2−的大
B . AsH3的沸点比NH3的低
C . Fe成为阳离子时首先失去3d轨道电子
D . 配合物Fe(CO)n可做催化剂,当Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18时,n=5
基态原子的核外电子排布式为[Kr]4d105s1 的元素所属的区、周期和族为( )
A . p 区、第五周期、第ⅠB 族
B . ds 区、第五周期、第Ⅷ族
C . d 区、第四周期、第ⅠB 族
D . ds 区、第五周期、第ⅠB 族
卤族元素是重要的非金属元素,用途广泛。回答下列问题:
-
(1) 卤族元素位于元素周期表区,其中电负性最大的是(填元素符号)。
-
(2) 基态氟原子核外有种运动状态不同的电子,其中含有单电子的轨道形状为。
-
(3) 溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性(填“强”或“弱”),原因是。
-
(4) 化合物 I3 AsF6为离子化合物,其中阳离子(I
 )中心原子的杂化方式为。该晶体中不含有的化学键类型为(填选项字母)。
)中心原子的杂化方式为。该晶体中不含有的化学键类型为(填选项字母)。 a.配位键 b.金属键 c.极性键 d.非极性键
-
(5) 由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为,晶胞中位置与 K+紧邻的 O 的个数为。

-
(6) 有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确。(已知:
 )
)
Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。
-
(1) 基态Cr2+与Fe的未成对电子数之比为。试从电子排布角度分析水溶液中Fe2+具有强还原性。若是形成将其转化为(NH4)2Fe(SO4)2 , 在空气中相对稳定,
 的空间构型为。
的空间构型为。
-
(2) 由环戊二烯(C5H6 ,
 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知  的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为,结构中的大π键可用符号表示
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为,结构中的大π键可用符号表示  ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为  )。则
)。则  结构中含有的大π键可表示为。
结构中含有的大π键可表示为。
-
(3) 某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为。几种Cr的卤化物的部分性质如表所示:
卤化物
CrCl3
CrBr3
CrI3
熔点/℃
1150
600
试预测CrBr3的熔点范围。
-
(4) 某晶体中含有K+、Ni2+、Fe2+、CN- , 其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-个。该物质常用于吸附Cs+ , 将取代晶胞中的K+ , 取代后的物质的化学式为。

刀片式 (简称LFP)电池的使用大幅降低了高端全电动汽车的成本。下列说法不正确的是( )
(简称LFP)电池的使用大幅降低了高端全电动汽车的成本。下列说法不正确的是( )
 (简称LFP)电池的使用大幅降低了高端全电动汽车的成本。下列说法不正确的是( )
(简称LFP)电池的使用大幅降低了高端全电动汽车的成本。下列说法不正确的是( )
A . 基态P原子核外未成对电子数为5
B . 基态Li原子核外电子的空间运动状态为球形
C . 基态 的价层电子排布式为
的价层电子排布式为 D . 基态O原子核外电子空间运动状态有5种
D . 基态O原子核外电子空间运动状态有5种
 的价层电子排布式为
的价层电子排布式为 D . 基态O原子核外电子空间运动状态有5种
D . 基态O原子核外电子空间运动状态有5种
我国科学家成功合成了一种具有超高能量且室温下稳定的盐(局部结构如图),其中含有两种10电子离子。下列说法错误的是 ( )
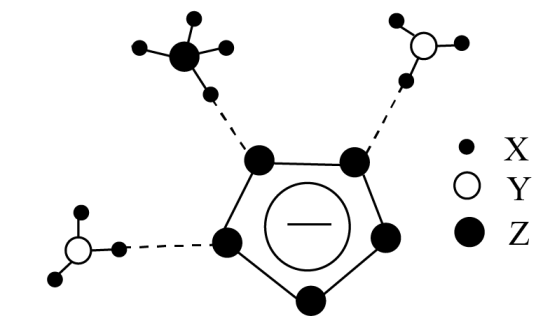
A . 经X射线衍射实验可测得该盐的晶体结构
B . 该盐可用于制造炸药
C . 两种10电子离子中均含配位键
D . 图中 离子中Z原子采取
离子中Z原子采取 杂化
杂化
 离子中Z原子采取
离子中Z原子采取 杂化
杂化
新型冠状病毒核酸检测多数采用荧光定量PCR方法,这种以荧光探针为核心的荧光检测技术具有灵敏度高、专一性强、快速响应和操作简单的特点,已成为环境检测、生物成像和医学诊断的强大工具。BTCu是荧光增强型Cu2+荧光分子探针,可对环境和生物体内的微量Cu2+进行有效检测。BTCu识别Cu2+机理如图:

回答下列问题:
-
(1) 基态Cu原子的价电子排布式为。
-
(2) BTCu中所含第二周期元素的第一电离能由小到大的顺序为 (用元素符号表示)。
-
(3) 探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有络合形式的参与。1 mol BTCu-Cu+中,Cu+形成的配位键有mol,B原子的杂化轨道类型是。
-
(4) 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CuFeS2的晶胞结构如图所示,已知:a=b=0.524 nm,c=1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。

①晶胞中原子分数坐标:A为(0,0,0);B为(1,0,0);C为(0,1,0)。找出距离Fe(0,0,0)最近的S (用分数坐标表示)。
②CuFeS2晶体的密度是g/cm3 (列出计算式)。
蛋白质主要由C、H、O、N四种化学元素组成,可能还会含有P、S等元素。铬是人体必需的微量元素。请回答下列有关问题:
-
(1) Cr的价层电子排布为。
-
(2) C、N、O三种元素第一电离能由大到小的顺序是。
-
(3) H、O、S三种元素电负性由小到大的顺序是。
-
(4) SO3分子的VSEPR模型名称为,
 空间结构名称是。
空间结构名称是。
-
(5) 化学式为CrCl3·6H2O的化合物有多种结构,其中一种可表示为[CrCl2(H2O)4]Cl·2H2O,该配合物中配位原子是,配位数为。
-
(6) H3O+中O原子的杂化类型是,H3O+中H-O-H键角(填“>”“<”或“=”)H2O中H-O-H键角。
-
(7) 铬和铝可形成
 ,
,  具有体心四方结构,如图所示。设Cr和Al的原子半径分别为
具有体心四方结构,如图所示。设Cr和Al的原子半径分别为 pm和
pm和 pm,则金属原子的空间占有率为%(列出计算表达式)。
pm,则金属原子的空间占有率为%(列出计算表达式)。
最近更新



