第二单元 离子键 离子晶体 知识点题库
下列说法错误的是( )
A . 在水中的溶解度NH3>CH4
B . 晶体熔点的高低SiO2>CO2
C . 金属键的强弱Li>K
D . 晶格能的大小NaF>MgO
RbH是一种离子化合物,它跟水反应的方程式为:RbH+H2O=RbOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是( )
A . 灼烧RbH时,火焰有特殊颜色
B . RbH中H+半径比Li+半径小
C . 跟液氨反应时,有RbNH2生成
D . 在Na、K、Rb三种单质中,Rb的熔点最高
下列物质中既含有离子键又含有共价键的是( )
A . CO2
B . KOH
C . MgCl2
D . Na2O
下列物质中,既含离子键、又含极性共价键的是( )
A . NaOH
B . Na2O
C . HCl
D . CaCl2
下列有关晶体的说法错误的是( )
A . 氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子
B . 在金刚石晶体中,1 mol碳原子形成2 mol碳碳共价键
C . 只有金属Po的晶体采取简单立方堆积,其空间利用率最高
D . 在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻
下列说法正确的是( )
A . 非金属单质中一定存在共价键
B . 含共价键的化合物一定是共价化合物
C . 含离子键的化合物一定是离子化合物
D . 溶于水能导电的化合物就是离子化合物
在Cl2、Na2S、Na2O2、HClO、H2O2、NH4Cl六种物质中:
-
(1) 其中只含非极性键的物质的电子式为;
-
(2) 其中只由极性键构成的物质是(填化学式);
-
(3) 其中由离子键和共价键构成的物质是(填化学式);
-
(4) H2O2属于共价化合物,其结构式为;
-
(5) 用电子式表示Na2S的形成过程.
下列物质中既有离子键又有共价键的可溶性化合物是( )
A . H2SO4
B . BaSO4
C . N2
D . NaOH
下列说法中错误的是( )
①质子数相同的微粒一定属于同一种元素
②共价化合物中不存在离子键
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④电子数相同的微粒不一定是同一种元素
⑤非金属元素之间不可能形成离子键
⑥离子键是指阴阳离子间的静电吸引力
⑦水受热不容易分解,原因是水分子间存在氢键
A . ②③⑤⑥
B . ①③⑤⑦
C . ①⑤⑥⑦
D . ③④⑤⑥
下列物质中含有共价键的离子化合物是()
①MgF2②Na2O2③NaOH④NH4Cl⑤CO2⑥H2O2⑦N2
A . ②③④
B . ②④⑤⑦
C . ①②③④⑥
D . ①③⑤⑥
既存在离子键又存在共价键的是( )
A . NaOH
B . 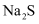 C . Ne
D .
C . Ne
D . 
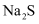 C . Ne
D .
C . Ne
D . 
据《Green Chemistry》报道:我国学者发明了低压高效电催化还原CO2的新方法,其总反应为:NaCl+CO2  CO+NaClO。下列说法正确的是( )
CO+NaClO。下列说法正确的是( )
 CO+NaClO。下列说法正确的是( )
CO+NaClO。下列说法正确的是( )
A . CO2的电子式: 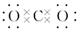 B . NaCl属于离子晶体, 其配位数为8
C . NaClO中既有离子键又有共价键
D . 还原22.4LCO2转移的电子数2NA
B . NaCl属于离子晶体, 其配位数为8
C . NaClO中既有离子键又有共价键
D . 还原22.4LCO2转移的电子数2NA
下列物质属于离子化合物且含有共价键的是( )
A . MgCl2
B . SiO2
C . CH3Cl
D . NH4Cl
下列是某同学对KHSO4的物质类型进行的分析,其中错误的是( )
A . 根据元素组成知它是化合物
B . 因它含有钾离子与酸根离子,故KHSO4是钾盐
C . KHSO4可以称为硫酸氢盐
D . 因为它含有与酸相同的元素氢,故KHSO4也可称为酸
下列物质中,含有共价键的离子晶体是( )
A . 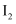 B . НСl
C . NaBr
D . KOH
B . НСl
C . NaBr
D . KOH
 B . НСl
C . NaBr
D . KOH
B . НСl
C . NaBr
D . KOH
氧化锌在液晶显示器、薄膜晶体管、发光二极管等产品中均有应用,常用下列三种锌盐为原料经高温分解制备。
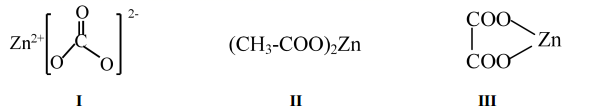
回答下列问题:
-
(1) Zn为30号元素,它在元素周期表中的位置是。
-
(2) 原料Ⅰ中阴离子空间结构为,其等电子体为(写出1种即可)。
-
(3) 原料Ⅱ、Ⅲ阴离子对应的酸沸点较高的是(写结构简式),原因是。
-
(4) 关于以上几种锌盐说法正确的是____。A . 化合物Ⅱ中电负性最大的元素是O B . 化合物Ⅱ中所有C原子的杂化形式均为sp3 C . 化合物Ⅲ中只存在离子键和极性共价键 D . 化合物Ⅰ阴离子中σ键和π键数目比为2:1
-
(5) ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,下图为这两种晶体的局部结构。

①图a不是纤锌矿型ZnO的晶胞单元,原因是。
②图b闪锌矿型属于立方晶胞,原子1的坐标为
 , 则原子2的坐标为。
, 则原子2的坐标为。③图
 的闪锌矿型ZnO晶体中离O距离最近的Zn原子数为,其晶胞参数为a nm,阿伏加德罗常数的值为NA , 则晶体密度为g/cm3(列出计算式)。
的闪锌矿型ZnO晶体中离O距离最近的Zn原子数为,其晶胞参数为a nm,阿伏加德罗常数的值为NA , 则晶体密度为g/cm3(列出计算式)。
铬在希腊文中的原意为“颜色”,能够生成美丽多色的化合物,三价铬离子能形成形形色色的络合物。回答下列问题:
-
(1) 铬位于元素周期表中区。
-
(2) 紫色的[Cr(H2O)6]3+、橙红色的[Cr(NH3)4(H2O)2]、灰绿色的Cr(CH3COO)3 , 部分结构示意图如图所示。

①氮和氧中第一电离能较大的元素是,原因是
②H2O和NH3中键角较大的分子是,[Cr(NH3)4(H2O)2]3+的同分异构体共有种,其结构中铬离子的外围电子数目为。
③1molCr(CH3COO)3所含σ键的数目为。
-
(3) 用铬原子代替部分铜原子,可以形成一系列铜—铬合金。其中两种铜—铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为。
②晶体b中铬原子填充在由铜原子构成的(填“四面体”“六面体”或“八面体”)空隙中,NA表示阿伏加德罗常数的值,则晶体b的密度为。
W、X、Y、Z是四种原子序数依次增大的短周期元素。a、b、c、d、e是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,e是由W、Y、Z元素形成的化合物,m为元素Y形成的单质。上述物质 的转化关系如图所示,下列说法正确的是 ( )

A . 简单离子半径: Z> Y
B . c是由极性键构成的非极性分子
C . e为离子化合物,含有离子键和共价键
D . W、X、Y形成的化合物不可能是离子化合物
类推是化学学习和研究中常用的思维方法,下列类推正确的是( )
A . H2O2的热稳定性比H2O的弱,则C2H6的热稳定性比CH4的弱
B . 晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
C . Mg—Al原电池,Mg的活泼性比Al强,在稀硫酸介质中,Mg做负极,则在稀氢氧化钠介质中,也是Mg做负极
D . 根据反应Fe(OH)3+3HCl=FeCl3+3H2O,可类推反应Fe(OH)3+3HI=FeI3+3H2O
下列说法错误的是( )
A . 从化学键角度分析,化学反应过程的本质是旧化学键断裂和新化学键形成的过程
B . 双原子单质分子中一定只含非极性共价键
C . 由非金属元素原子组成的化合物中一定只含共价键
D . 由于液态氯化氢不存在自由移动的离子,因此不能导电
最近更新



