第三单元 共价键 共价晶体 知识点题库
下列说法不正确的是( )
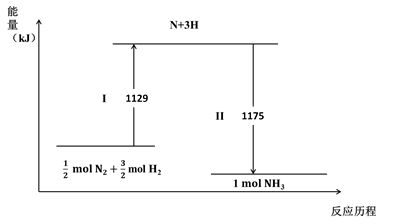
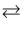 2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
-
(1) N2分子中两个N原子都达到8电子稳定状态,则两个N原子之间共有电子的数目为;白磷的分子式为P4 , 4个P原子相互之间共形成6个共价单键,且每个P原子都达到8电子稳定状态,则白磷分子的空间构型为。
-
(2) N、P两种元素都能形成多种气态氢化物。联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式,联氨与磷酸(H3PO4)形成的磷酸二氢盐的化学方程式为。
-
(3) P2O5是一种干燥剂,下列气体不能用P2O5干燥的是________(填字母序号)。A . SO2 B . NH3 C . CO D . H2 E . H2S F . O2
-
(4) 次磷酸(H3PO2)是一元中强酸,它的工业制法是将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2 , 后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式,Ba(H2PO2)2为(填“正盐”或“酸式盐”)。
-
(1) C、N、O的电负性由大到小的顺序为。
-
(2) 写出Cu的核外电子排布式。
-
(3) 化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为。
-
(4) 在一定条件下NH3和CO2能合成尿素CO(NH2)2 , 尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为。
-
(1) 下列五种物质中,①Ar ②CO2 ③SiO2 ④NaOH ⑤K2S只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。(填序号)
-
(2) 分别用电子式表示下列物质CaBr2 H2S

-
(1) 下列说法中正确的是。
a.碳的电子式是
 ,可知碳原子最外层有4个单电子
,可知碳原子最外层有4个单电子b.12 g石墨烯含共价键数为NA
c.从石墨剥离得石墨烯需克服共价键
d.石墨烯中含有多中心的大π键
-
(2) COCl2分子的空间构型是。其中,电负性最大的元素的基态原子中,有种不同能量的电子。
-
(3) 独立的NH3分子中,H-N-H键键角106.70。如图是[Zn(NH3)6]2+离子的部分结构以及其中H-N-H键键角。

请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.50的原因是。
-
(4) 化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7℃,其中EMIM+结构如图所示。

该物质晶体的类型是。大π键可用符号
 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为。 -
(5) 碳化钙的电子式:
 ,其晶胞如图所示,晶胞边长为a nm、CaC2相对式量为M,阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为g·cm−3;晶胞中Ca2+位于C22-所形成的正八面体的体心,该正八面体的边长为nm。
,其晶胞如图所示,晶胞边长为a nm、CaC2相对式量为M,阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为g·cm−3;晶胞中Ca2+位于C22-所形成的正八面体的体心,该正八面体的边长为nm。 
-
(1) A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为 ,其中心原子的杂化方式为 ;A分别与B、C、D形成的共价化合物中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,任意写出三种)。
-
(2) 这些元素形成的含氧酸根离子中,其中心原子的价电子对数为3的酸根离子是 ( 填化学式,下同) ;酸根离子呈三角锥形结构的是。
-
(3) BA4分子的空间结构为;根据电子云重叠方式的不同,该分子中共价键的类型为。
-
(4) B的一种氢化物相对分子质量是26,其分子中σ键和π键的数目之比为 。

选项 | 事实 | 解释 |
A | 分别向K3[Fe(CN)6]溶液和Fe(SCN)3溶液中滴加等浓度的氢氧化钠溶液,只有Fe(SCN)3溶液中有黄色沉淀生成 | CN-对Fe3+的配位能力比SCN-更强,溶液中没有Fe3+ |
B | 向碘的四氯化碳溶液中加入适量浓KI溶液,振荡试管,溶液紫色变浅 | c(I-)增大,I2+I- |
C | 向酸式滴定管中加入蒸馏水,打开活塞让水缓缓流下,可看到水呈直线状垂直流入烧杯中。若用头发摩擦过的气球靠近,水流会向一侧偏转 | 水分子中含有极性键,会受到带电物体的吸引 |
D | 向盛有AgCl沉淀的试管中滴入足量1mol/L氨水,振荡,溶液变澄清 | AgCl+2NH3=[Ag(NH3)2]Cl,NH3的N接受电子对 |
 , 其原子序数依次增大,部分信息如下表:
, 其原子序数依次增大,部分信息如下表:
|
X |
阴离子电子层结构与氨原子相同 |
|
Y |
最高价氧化物在空气中增多会造成温室效应 |
|
Z |
双原子单质分子中 |
|
W |
基态原子的价电子排布式为 |
|
M |
短周期元素中原子半径最大 |
|
Q |
元素最高化合价与最低化合价的代数和等于4 |
请用相应的化学用语回答下列问题:
-
(1) 中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是
-
(2) 基态Q原子的核外电子排布中,电子占据的最高能级符号是,其电子云轮廓图为形。
-
(3) Z的电负性W的电负性(填“>”或“<”,下同),Z的第一电离能W的第一电离能,
 的简单离子半径由大到小的顺序是 (用离子符号回答)。
的简单离子半径由大到小的顺序是 (用离子符号回答)。
-
(4)
 的
的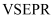 模型是,
模型是, 分子中的键角是
分子中的键角是
-
(5) 已知:①
 ;
;
②
 ;
;③
 中
中 键的键能为
键的键能为 。
。则
 的
的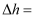 。
。 -
(6)
 中的
中的 键角比
键角比 中的
中的 键角大,原因是。
键角大,原因是。
 发生反应:
发生反应: 。下列说法错误的是( )
。下列说法错误的是( )
 和H2O与Zn2+的配位能力:
和H2O与Zn2+的配位能力: D .
D .  中,σ键和π键数目之比为1∶1
中,σ键和π键数目之比为1∶1
-
(1) 基态氧原子中能量最高的电子,其电子云有个伸展方向 (取向) ;基态Mn原子的电子排布式为。
-
(2) Ni2+在水中以水合离子[Ni(H2O)6]2+形式存在,它与乙二胺 (
 , 简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。
, 简写为en)反应后溶液变为蓝色,反应为: [Ni(H2O)6]2+ + 2en= [Ni(en)2(H2O)2]2+ (蓝色)+ 4H2O。①1个乙二胺分子中含sp3杂化的原子个数为,分子中电负性最大的元素是 ;
②Ni(H2O)6]2+中H2O与Ni2+之间以键结合在一起,在与乙二胺反应的过程中,Ni2+的轨道杂化类型是否发生改变? (填“是”或“否”) ;
③沸点:乙二胺(116℃)<乙二醇(197℃), 其原因是:。
-
(3) 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子分数坐标。已知TiO2为四方晶系(长方体形),晶胞参数为459pm、459pm、 295pm。 如图为沿y轴投影的晶胞中所有O原子和Ti原子的分布图和原子分数坐标。
①该晶胞中O原子的数目为。
②设NA为阿伏加德罗常数的值,TiO2 的摩尔质量为80g/mol,则TiO2晶胞的密度为g·cm-3(列出计算表达式)

-
(1) B、C、D的第一电离能由大到小的顺序为(填元素符号)。
-
(2) 简单氢化物的稳定性:CD(填“>”或“<”),原因为.
-
(3) 分子式为ABC的化合物属于(填“极性”或“非极性")分子,其结构中
 键与
键与 键的比例为。
键的比例为。
-
(4) 桂皮中含有的肉桂醛(
 )是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构特征,分析预测其可发生如下反应,完成表格。
)是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构特征,分析预测其可发生如下反应,完成表格。序号
参与反应的试剂
反应方程式
反应类型
①
新制的氢氧化铜
②
溴的四氯化碳溶液
 I
I 平衡向右移动
平衡向右移动



