第一单元 分子的空间结构 知识点题库
下列物质的分子正负电荷重心不相重合的是( )
A . C2H2
B . CO2
C . NH3
D . BF3
下列说法正确是( )
A . 含有极性键的分子一定是极性分子
B . 单质分子一定是非极性分子
C . 氢键一定与氢元素有关
D . 共价键只存在于非金属元素之间
将下列粒子的符号填入相应的空格内:O2、NH3、CO2、H2O、N2、(NH4)2SO4、SiCl4 .
-
(1) 存在极性键的极性分子是.
-
(2) 存在非极性键的非极性分子是.
-
(3) 存在极性键的非极性分子是.
-
(4) 全部由非金属元素组成的离子化合物是.
A~G是几种烃的分子球棍模型(如图)

据此回答下列问题:
-
(1) 常温下含碳量最高的气态烃是(填对应字母).
-
(2) 能够发生加成反应的烃有(填数字)种.
-
(3) 一卤代物种类最多的是(填对应字母).
-
(4) 写出实验室制取C的化学方程式.
-
(5) 写出F发生溴代反应的化学方程式.
所谓手性分子是指在分子中,当一个碳原子上连有彼此互不相同的四个原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.凡是有一个手性碳原子的物质一定具有光学活性.例如,有机化合物(  )有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
)有光学活性.则该有机化合物分别发生如下反应后,生成的有机物仍有光学活性的是( )
A . 与乙酸发生酯化反应
B . 与NaOH水溶液共热
C . 与银氨溶液作用
D . 在催化剂存在下与氢气作用
我国化学家首次实现了膦催化的 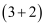 环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
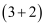 环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。 已知 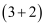 环加成反应:
环加成反应: 
![]()
(  、
、  可以是
可以是  或
或  )
)
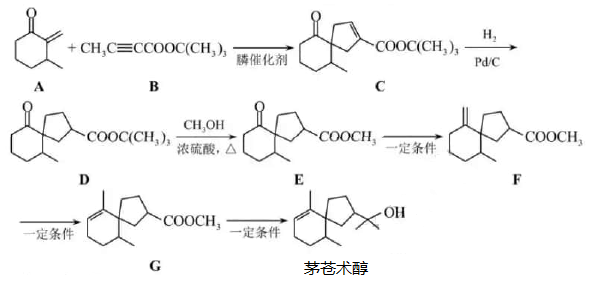
回答下列问题:
-
(1) 茅苍术醇的分子式为,所含官能团名称为,分子中手性碳原子(连有四个不同的原子或原子团)的数目为。
-
(2) 化合物B的核磁共振氢谱中有个吸收峰;其满足以下条件的同分异构体(不考虑手性异构)数目为。
①分子中含有碳碳三键和乙酯基

②分子中有连续四个碳原子在一条直线上
写出其中碳碳三键和乙酯基直接相连的同分异构体的结构简式。
-
(3)
 的反应类型为。
的反应类型为。
-
(4)
 的化学方程式为,除
的化学方程式为,除 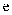 外该反应另一产物的系统命名为。
外该反应另一产物的系统命名为。
-
(5) 下列试剂分别与
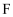 和
和 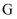 反应,可生成相同环状产物的是(填序号)。
反应,可生成相同环状产物的是(填序号)。 a.
 b.
b. 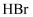 c.
c.  溶液
溶液 -
(6) 参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物
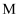 ,在方框中写出路线流程图(其他试剂任选)。
,在方框中写出路线流程图(其他试剂任选)。 
下列表示错误的是( )
A . Na+ 结构示意图  B . 乙烷的球棍模型
B . 乙烷的球棍模型  C . 乙炔的结构简式C2H2
D . 氯化钙的电子式
C . 乙炔的结构简式C2H2
D . 氯化钙的电子式 
利用空气将氯化氢催化氧化,使之转化为氯气,已成为工业上生产氯气的重要途径,其反应为4HCl+O2=2H2O+2Cl2。下列化学用语表达正确的是( )
A . 质量数为18的氧原子:  O
B . 水的电子式:
O
B . 水的电子式:  C . HCl分子的球棍模型:
C . HCl分子的球棍模型:  D . Cl-的结构示意图:
D . Cl-的结构示意图: 
 O
B . 水的电子式:
O
B . 水的电子式:  C . HCl分子的球棍模型:
C . HCl分子的球棍模型: 
下列表示正确的是( )
A . MgF2的电子式: 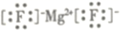 B . 氯化钠的分子式:NaCl
C . 二氧化碳的比例模型:
B . 氯化钠的分子式:NaCl
C . 二氧化碳的比例模型:  D . 乙烯的结构式:CH2=CH2
D . 乙烯的结构式:CH2=CH2
如图是常见四种有机物的比例模型示意图。下列说法错误的是( )

A . 甲不能使酸性高锰酸钾溶液褪色
B . 乙可与溴的四氯化碳溶液发生加成反应使其褪色
C . 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D . 丁可由乙与水发生取代反应生成
下列各组物质不互为等电子体的是( )
A . CO和N2
B . CO2和N2O
C . CO  和NO
和NO  D . CO2和SO2
D . CO2和SO2
 和NO
和NO  D . CO2和SO2
D . CO2和SO2
下列数据是对应物质的熔点,有关的判断错误的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
A . 同族元素的氧化物可形成不同类型的晶体
B . 含有金属阳离子的晶体不一定是离子晶体
C . 在共价化合物分子中各原子都形成8电子结构
D . 金属晶体的熔点不一定比分子晶体的高
下列说法正确的是( )
A . 甲烷的比例模型:  B . 乙烯的结构简式:
B . 乙烯的结构简式: 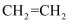 C . 次氯酸的结构式为H-Cl-O
D .
C . 次氯酸的结构式为H-Cl-O
D .  的电子式:
的电子式: 
 C . 次氯酸的结构式为H-Cl-O
D .
C . 次氯酸的结构式为H-Cl-O
D .  的电子式:
的电子式: 
过渡元素在工业、农业、科学技术以及人类生活等方面有着重要作用。请回答下列问题:
-
(1) 基态Cu原子的核外电子排布式为。
-
(2) 高密度磁记录材料纳米钴(Co)可通过亚肼(N2H2)还原氯化亚钴来制备。
①N2H2分子中氮原子的杂化形式为。
②亚肼(N2H2)分子中四个原子在一个平面上,由于几何形状的不同,它有两种同分异构体
 和
和  ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是。
,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是。③Co3+能与NH3和N
 形成配离子[Co(N3)(NH3)5]2+ , 在该配离子中Co3+的配位数为;写出与N
形成配离子[Co(N3)(NH3)5]2+ , 在该配离子中Co3+的配位数为;写出与N  互为等电子体的分子:(任写一种,填化学式);N
互为等电子体的分子:(任写一种,填化学式);N  的空间构型是。
的空间构型是。 -
(3) FeO、NiO晶胞结构相同,晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点:NiOFeO(填“>”或“<”),原因是;已知NiO晶体结构中阴、阳离子的配位数均为6,则NiO晶胞的俯视图可能是(填字母序号)。

-
(4) CdS的立方晶胞结构如图所示,已知阿伏加德罗常数的值为NA , 该晶胞的晶胞参数为apm,该晶体的密度为ρg/cm-3 , 则Cd原子的相对原子质量的数值近似为(用含ρ、NA、a的代数式表示)。

如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。下列叙述错误的是( )

A . 键角为 120°
B . 电负性:O > Si
C . 硅原子采用 sp3 轨道杂化方式
D . 化学组成为 

能用键能解释,且结论正确的是( )
A . 熔点:金刚石>晶体硅
B . 分子稳定性:H2O>HF
C . 水中的溶解度:SO2>CO2
D . 状态:常温时,Cl2是气态,Br2为液态
化学符号是化学学科的语言。下列有关化学用语表示正确的是( )
A . H2S的电子式:  B . 乙酸的球棍模型:
B . 乙酸的球棍模型:  C . S2-的结构示意图:
C . S2-的结构示意图:  D . CCl4的电子式
D . CCl4的电子式 
 C . S2-的结构示意图:
C . S2-的结构示意图:  D . CCl4的电子式
D . CCl4的电子式 
下列化学用语表示错误的是( )
A . CO2的分子模型示意图: B . sp2杂化轨道模型:
B . sp2杂化轨道模型: C . HIO的电子式:
C . HIO的电子式: D . HCN的结构式:H—C≡N
D . HCN的结构式:H—C≡N
 B . sp2杂化轨道模型:
B . sp2杂化轨道模型: C . HIO的电子式:
C . HIO的电子式:
(CH3NH3)PbI3是钙钛矿太阳能电池的重要吸光材料,其晶胞结构如图1所示,Walsh提出H2O降解(CH3NH3)PbI3的机理如图2所示。

下列说法错误的是( )
A . H3O+的键角小于H2O的键角
B . 1个(CH3NH3)PbI3晶胞含有3个I-
C . 机理中的反应均为非氧化还原反应
D . H2O可与CH3NH 反应生成H3O+和CH3NH2
反应生成H3O+和CH3NH2
 反应生成H3O+和CH3NH2
反应生成H3O+和CH3NH2
有机物“PX”的结构模型如图(图中白球代表氢原子,灰球代表碳原子),下列说法错误的是( )
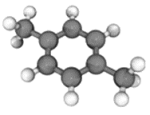
A . 分子式为C8H10
B . 二氯代物共有6种
C . 分子中最多有14个原子共面
D . 难溶于水,易溶于四氯化碳
最近更新



