饱和溶液与不饱和溶液相互转变 知识点题库
右图所示是a、b、c(不含结晶水)三种固体物质的溶解度曲线,下列说法正确的是( )
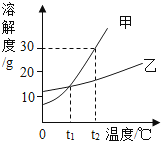
如图是甲、乙两种固体物质在水中的溶解度曲线,下列说法不正确的是( )

如图是甲乙两种固体物质的溶解度曲线,下列说法正确的是( )
水是人类最宝贵的资源,也是一种常用的溶剂.用你学过的化学知识回答下列问题:
(1)自然界中的水都不是纯水,欲除去水中不溶性杂质,需进行过滤操作,该操作过程中玻璃棒所起的作用是 .
(2)某同学在完成电解水实验时,发现正极产生4mL气体,则负极产生的气体体积是 mL.
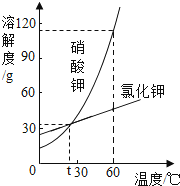
(3)如图所示是硝酸钾和氯化钾的溶解度曲线.
① ℃时,两种物质的溶解度相等.
②60℃时,将硝酸钾的饱和溶液转化为不饱和溶液的方法有(填一种).
a,b两种物质的溶解度曲线如图所示.下列说法不正确的是( )

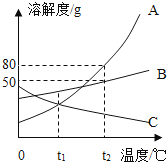
A、B、C三种固体物质的溶解度曲线如图所示,据图回答问题:
(1)温度为 ℃时,A与C物质的溶解度相等;
(2)将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,有晶体析出的是 (填字母代号);
(3)t2℃时,把A、B物质各50g分别加到100g水中,不能形成饱和溶液的是 (填字母代号),若要使之达到饱和状态,还需要向溶液中加入 g该溶质.
①如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.5 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
-
(1) 表中的两种物质在40℃时,的溶解度较大;
-
(2) 请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法.
-
(3) 20℃时,将20g NaCl放入50g水中,所得溶液的质量是 g.
-
(4) 从NaCl溶液中得到NaCl晶体的方法是.
-
(5) 60℃时,NaCl饱和溶液比KNO3的不饱和溶液浓(填“一定”“不一定”)
|
温度(℃) |
0 |
20 |
40 |
|
溶解度(g/100g 水) |
13.3 |
31.6 |
63.9 |
-
(1) 称取 30gKNO3 固体时,在加一定量的 KNO3 后发现托盘天平指针偏右,接下来的操作是,直到天平平衡。
-
(2) 20℃时的,将 30gKNO3 固体加入到盛有 100g 水的烧杯中,所得溶液是否饱和?。
-
(3) 要使 20℃时的 KNO3 不饱和溶液变为饱和溶液,可采用的方法。(写出一种即可)
|
温度/℃ |
0 |
20 |
80 |
|
|
溶解度/g |
氢氧化钙 |
0.187 |
0.141 |
0.094 |
|
氢氧化钡 |
1.67 |
8.22 |
101.4 |
|
根据以上信息回答下列问题。
-
(1) 20℃时,氢氧化钡属于物质。(选填“易溶”“可溶”“微溶”“难溶”)
-
(2) 将氢氧化钙的不饱和溶液转为饱和溶液,可采取的方法是。(只举一种)

-
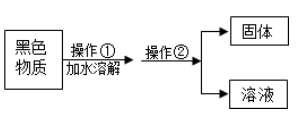
(1) 操作②的名称是。
-
(2) 小柯同学欲配置30℃的氯化铵饱和溶液来去除金属表面的氧化物,查右图中的溶解度曲线图(如图)可知:30℃时,100克水中最多能溶解克氯化铵。
-
(3) 将接近饱和氯化钠溶液变为饱和氯化钠溶液,可行的方法之一是添加溶质 (氯化钠),还可以是。
-
(4) 你从图中还可获得什么信息(写出一条即可):。
|
物质温度/℃ |
20 |
40 |
60 |
80 |
|
氯化铵/g |
37.2 |
45.8 |
55.2 |
65.6 |
-
(1) 操作②的名称是。
-
(2) 小新同学欲配置40℃的氯化铵饱和溶液来去除金属表面的氧化物,根据溶解度表可知:40℃时,100克水中最多能溶解克氯化铵。
-
(3) 将接近饱和的氯化铵溶液变为饱和氯化铵溶液,可行的方法是(写出其中一种)。
-
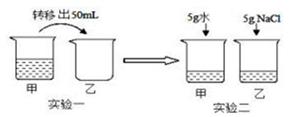
(1) 20℃时,甲烧杯中溶液是(选填“饱和”或“不饱和”)溶液;一定能使甲烧杯中的固体A继续溶解的方法是。
-
(2) 求乙烧杯中B溶液的溶质质量分数(请列式计算)。
|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
|
溶解度(g) |
13.3 |
31.6 |
63.9 |
110 |
169 |
-
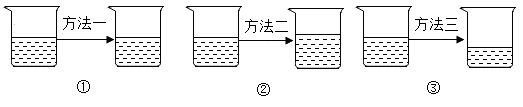
(1) 60℃时,欲使一瓶接近饱和的硝酸钾溶液转化为饱和溶液,除了添加溶质外,还可以采取的方法是 。
-
(2) 现将300g40%的硝酸钾稀释成30%,需加水多少克?
| 实验小组 | 第一组 | 第二组 | 第三组 | 第四组 |
| 水的质量/g | 50 | 50 | 50 | 50 |
| 所取食盐的质量/g | 15 | 20 | 25 | 30 |
| 剩余食盐的质量/g | 0 | 2 | 7 | 12 |
下列说法错误的是( )



