盐的性质及用途 知识点题库
序号 | 实验目的 | 实验方案 |
① | 证明变质 | 取少量固体,加水溶解,滴加足量稀盐酸,观察是否有气泡产生 |
② | 确定成分 | 取少量固体,加入石灰水,过滤,向滤液中滴加酚酞试液 |
③ | 测定纯度 | 取a g样品与足量氯化钡溶液充分反应,将沉淀过滤、洗涤、干燥,得到m g固体 |
④ | 除去杂质 | 取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤 |
构建知识网络是学习化学的重要方法,如图是不同物质相互转化关系图.其中A、B、C、D属于不同类别的物质,且都含有铜元素,B为黑色粉末,C为红色粉末.“→”表示一种物质一步转化成另一种物质(部分反应物、生成物及反应条件未标出),请回答问题:
(1)C的化学式 ,A的化学式 .
(2)写出由B生成硫酸铜的化学方程式 .
(3)在该知识网络所涉及的化学反应中,可以归纳出能与盐发生反应的物质类别有 .
A、单质 B、氧化物 C、酸 D、碱 E、盐.

步骤 | 现象 | 结论 | |
(1) | 各取少量白色粉末于试管中,分别编号为A、B、C、D,各加入少量的水,振荡 | D试管溶液呈色 | D物质是硫酸铜 |
(2) | 向另三支试管内各滴一滴无色酚酞 | A试管溶液呈红色 | A物质是 |
(3) | 向B、C两支试管内各滴加少量的溶液 | B试管无现象,C试管产生白色沉淀 | B物质是硝酸钾 C物质是氯化钠 |
物质 | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
溶于水 | 无色、弱碱性 | 无色 |
加热 | 放出有臭味的气体 | 无反应 |
跟硝酸银溶液反应 | 生成浅黄色沉淀 | 生成白色沉淀 |
跟稀盐酸反应 | 放出红棕色的气体 | 无反应 |
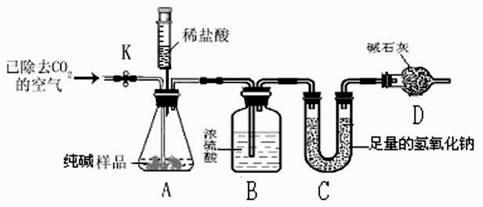
-
(1) 打开止水夹 K,先对装置 A 和 B(已连接)通入已除去 CO2 的空气一会儿,其目的是,再接上装置 C 和 D。
-
(2) 待装置 A 中的反应结束后,再一次打开止水夹 K,继续往装置通入已除去 CO2 的空气一会儿。根据质量守恒定律,装置(填标号)在反应前后的质量差就是产CO2 的质量,由此计算出该样品中 Na2CO3 的质量分数。
-
(3) 若省略 B 装置,将会使测定结果(选填“偏大”、“不变”或“偏小”)。
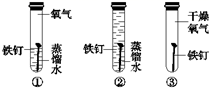
-
(1) 用来清除铁锈的物质;
-
(2) 常用降低土壤酸性的是;
-
(3) 在日常生活中用做腌制食物的是;
-
(4) 少量存于胃液中帮助消化的是;
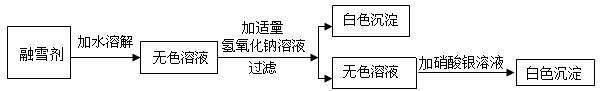
请你根据以上设计过程,完成下列空白:
-
(1) 该融雪剂中一定含有(写化学式,下同)。
-
(2) 一定不含有的物质 。

-
(1) 步骤①⑤⑦中都用到的一种玻璃仪器为。
-
(2) 判断BaCl2已过量的方法是。
-
(3) 第④步中,相关的化学方程式有。
【演示实验】老师按如图所示连接好装置,加入NaHCO3粉末,点燃酒精灯,对试管预热后集中加热,烧杯中澄清石灰水变浑浊,说明生成了CO2.继续加热至无气体产生后撤出导管,熄灭酒精灯。
【问题提出】实验后,同学们对试管中剩余的固体粉末产生了兴趣:剩余粉末由什么物质组成?
【猜想假设】在老师的指导下,同学们对固体粉末作出了如下猜想:
猜想一:NaOH;猜想二:NaOH和Na2CO3;猜想三:Na2CO3。
【实验探究】
实验方案 | 实验操作 | 实验现象 |
方案一 | 取适量粉末溶于水后向溶液中滴入2滴酚酞溶液,摇匀 | 溶液由无色变红色 |
小明根据实验现象认为固体粉末中一定有NaOH。小组讨论后,大家认为小明的结论不合理,理由是。
实验方案 | 实验操作 | 实验现象 | 实验结论 | |
方案二 | 步骤一 | 取适量粉末溶于水后加 入过量的BaCl2溶液 | 猜想一不成立 | |
步骤二 | 取步骤一的上层清液加入MgCl2溶液2−3mL | 无明显现象 | 猜想三成立 | |
【评价交流】小华认为步骤二也可以用MgSO4代替MgCl2 , 大家不同意他的观点,理由是。
 CO
CO  CO2
CO2  Na2CO3
B . Cu
Na2CO3
B . Cu 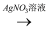 Cu(NO3)2溶液
Cu(NO3)2溶液  Cu(OH)2
C . Fe
Cu(OH)2
C . Fe  Fe2O3
Fe2O3 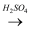 Fe2(SO4)3溶液
D . CaO
Fe2(SO4)3溶液
D . CaO  Ca(OH)2溶液
Ca(OH)2溶液 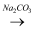 NaOH 溶液
NaOH 溶液

-
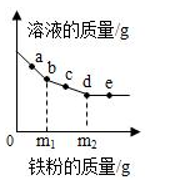
(1) 小明认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小明的观点是否正确,并说明理由。。
-
(2) 小明通过乙图实验确定了样品是部分变质,实验过程中滴加的氯化钡必须足量,其目的是。
-
(3) 下列溶液能代替乙图实验中的氯化钡溶液,起到相同的作用的有 。(可多选)A . 氢氧化钡 B . 硝酸钡 C . 硝酸钙 D . 氯化钙
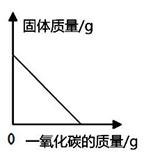 实验室中用一氧化碳还原氧化铁
B .
实验室中用一氧化碳还原氧化铁
B . 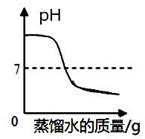 往氢氧化钙溶液中逐滴加入蒸馏水
C .
往氢氧化钙溶液中逐滴加入蒸馏水
C . 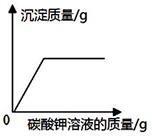 向盐酸和氯化钙的混合溶液中逐滴加入碳酸钾溶液
D .
向盐酸和氯化钙的混合溶液中逐滴加入碳酸钾溶液
D . 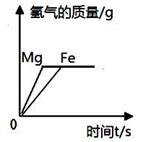 将足量粉末状金属分别与等质量、等质量分数的稀盐酸反应
将足量粉末状金属分别与等质量、等质量分数的稀盐酸反应
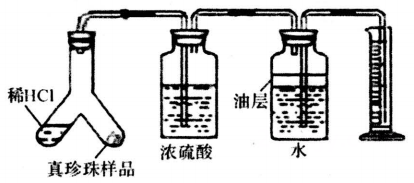
-
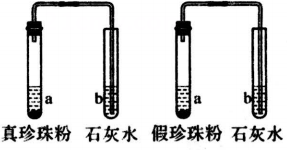
(1) 为了寻找区分真假珍珠粉的方法,科学兴趣小组的同学进行了下列实验:
实验一:分别取真假珍珠粉各少许置于两支试管中,加一定量的稀盐酸后迅速塞紧橡皮塞,将导管的另一端放入石灰水中,观察均发现:试管a中均有气泡产生;试管b中石灰水均变,由此可得结论:真假珍珠粉均含有碳酸钙;
实验二:分别取少量真假珍珠粉置于铁片上灼烧,发现真珍珠粉能闻到烧焦羽毛气味;假珍珠粉没有闻到烧焦羽毛气味,由此可得出结论:假珍珠粉中不含。
-
(2) 为了探究真珍珠粉中碳酸钙的含量,实验小组同学取5g真珍珠粉样品,分别置于如下图实验装置中(稀盐酸足量且真珍珠粉中只有碳酸钙与稀盐酸会反应生成气体)。
①装置中浓硫酸的作用 ▲ ;
②当量筒中的液面不再上升时,根据量筒中水的体积求得二氧化碳质量,多次实验后求得5g真珍珠粉生成的二氧化碳的质量为0.22g,求该真珍珠粉样品中CaCO3的质量分数。
【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氧化钠和碳酸钠的混合物。
-
(1) 思考:小科建立上述假设的依据是定律。
-
(2) 【进行实验】
步骤1:取灰白色固体于烧杯中,加入适量的水充分溶解过滤,得到滤液。
步骤2:取少量步骤1中的滤液于试管中,滴加2滴酚酞试液,溶液变成红色。
【得出结论】白色固体的成分是氧化钠。
有同学认为通过上述实验得出的结论不正确,其理由是。
-
(3) 【继续实验】
步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,则假设不成立。
-
(4) 步骤4:另取少量步骤1中的滤液于试管中,(写出具体操作及现象),则假设二成立。



