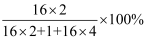物质组成的综合计算 知识点题库
(猜想)Fe2O3能否作为H2O2分解的催化剂。
(实验验证)小红同学一次设计了三个实验
实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,观察到木条没有复燃,说明H2O2溶液常温下分解缓慢。
-
(1) 实验二:在实验一的试管中加入wg Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,观察到木条复燃,说明。
-
(2) 实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为wg,说明。
(实验结论)小红同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。
-
(3) (反思评价)小明同学认为要证明小红同学的结论正确,仅做这三个实验还不充分,需要补充一个探究实验,探究。
-
(4) (拓展)下表是同学们探究影响H2O2分解因素时所记录的部分数据:
用足量等体积H2O2溶液制取相同体积O2所需时间

通过对表格中的数据进行分析,你能得出的结论是。
-
(5) (延伸)小明同学看到Fe2O3也能做H2O2分解的催化剂,还联想到一种蓝色的CuSO4溶液也能做H2O2分解的催化剂,请你一起参与计算:
①CuSO4的相对分子质量;
②80gCuSO4与多少克Fe2O3含有相等质量的氧元素?(写出计算过程)

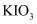 或氯化钠性质不稳定
D . 1kg该碘盐中最多含
或氯化钠性质不稳定
D . 1kg该碘盐中最多含 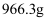 的氯化钠
的氯化钠

-
(1) 环节Ⅰ:利用海水提取粗盐的过程(如图).
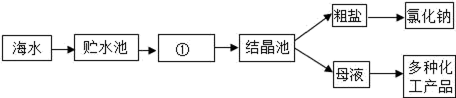
图中①是(填“蒸发”或“冷却”)池.
-
(2) 母液为氯化钠的(填“饱和”或“不饱和”)溶液.
-
(3) 环节Ⅱ:利用工业上粗盐(含MgCl2、CaCl2、Na2SO4等杂质)精制氯化钠(工艺流程如图).
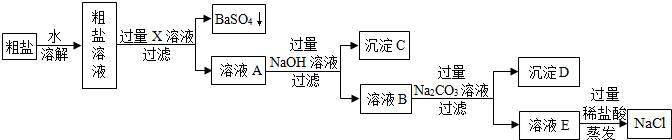
X中含有的阳离子是;
-
(4) 写出生成沉淀D的一个化学方程式.
-
(5) 溶液E中加过量稀盐酸的作用是.
-
(6) 实验所得精盐的质量大于粗盐中NaCl的质量,原因是.
-
(7) 环节Ⅲ:电解饱和食盐水生产氯气和烧碱并测定烧碱的纯度.
请写出环节Ⅲ生产中发生反应的化学方程式.
-
(8) 工业烧碱常常含有一定的氯化钠和碳酸钠杂质.为了测定烧碱的含量,小婉同学设计探究方案后进行实验并测得数据如图:
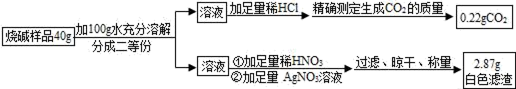
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程).
-
(9) 小强同学认为小婉同学设计的探究方案不够严密,其理由是:
①探究方案中没考虑氢氧化钠的吸水性.
②探究方案中因缺少(填操作名称),导致测得的氢氧化钠的质量分数偏小.
-
(10) 环节Ⅳ:应用举例
氯气与氢氧化钠溶液反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,工业上用氯气与石灰乳[Ca(OH)2]反应来制取漂白粉,有关反应的化学方程式是.
-
(1) 某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究对反应速率的影响。
编号
温度
催化剂
氯酸钾、二氧化锰的质量比
生成1升氧气所需时间/s
实验I
400
MnO2
1:1
153
实验Ⅱ
400
MnO2
2:1
240
-
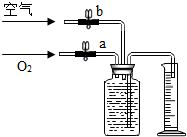
(2) 小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想。
(猜想)过氧化钙与水反应可制取氧气。
实验装置
实验主要现象
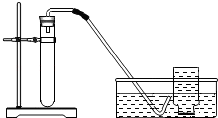
试管中加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。
实验结论:过氧化钙与水反应(填“能”或“不能”)用于实验室制取氧气。
(分析与反思)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议。
-
(3) (计算)该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

①过氧化钙的相对分子质量为;
②过氧化钙中钙元素与氧元素的质量比为;
③多少克的过氧化钙与100g碳酸钙CaCO3含钙量相当。(写出计算过程)
 2Cu2O+O2↑.现将16gCuSO4高温加热一段时间。冷却后称量剩余固体为 7.6g。下列说法正确的是( )
2Cu2O+O2↑.现将16gCuSO4高温加热一段时间。冷却后称量剩余固体为 7.6g。下列说法正确的是( )
 2FeO + CO2 , 反应前Fe2O3的质量为160克,反应后测得固体中铁元素与氧元素的质量比是14:5,则剩余固体是( )
2FeO + CO2 , 反应前Fe2O3的质量为160克,反应后测得固体中铁元素与氧元素的质量比是14:5,则剩余固体是( )
-
(1) 该样品中氧化铁的质量分数;
-
(2) 加入的稀硫酸的质量。