用水稀释改变浓度的方法 知识点题库
欲配制100g10%的NaCl溶液,操作如图所示.

请回答下列问题:
-
(1) 图中操作有错误的是 (填序号).
-
(2) 配制该溶液时,需要NaCl固体 g.
-
(3) 量取溶剂时,采用仰视的方法读数,会导致溶液的溶质质量分数 (“偏大”、“偏小”或“无影响”).
-
(4) 将配好的溶液稀释成溶质质量分数为5%的NaCl溶液,需加入 g水.
 B .
B .  C .
C .  D .
D . 
(1)稀释后的硫酸溶液的体积是多少?(计算结果精确到0.1)
(2)需要加水的体积为多少?
硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用.如图所示是硫及其化合物的转化流程: ![]()
-
(1) 上述A、B、C、D四种物质中,硫元素化合价为+4的氧化物的化学式是.(填化学式)
-
(2) 请写出B→C的化学方程式:.
-
(3) 上述过程制得的是浓硫酸,将500g质量分数为98%的浓硫酸稀释成质量分数为9.8%的稀硫酸,需要加水的质量为g,稀释浓硫酸的具体方法为.
①下列有关水和空气的叙述中正确的是 .
A.地球上水的总储量很大,但淡水资源并不充裕
B.充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生
C.目前计入空气质量日报的主要污染物中已包括了二氧化碳
D.空气是重要的自然资源,利用其成分可以制造许多产品
②溶解了较多的可溶性钙和镁的化合物的水属于硬水,实验室中一般可用 的方法来降低水的硬度.
③实验室欲将200g质量分数为10%的氯化钠溶液稀释为5%的稀溶液,需加水的质量为 g.
-
(1) 水是最常见的溶剂,将少量下列物质分别加入水中,不能形成溶液的是 .A . 面粉 B . 白糖 C . 冰块 D . 植物油 E . 硝酸钾
-
(2) 汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.请回答下列有关问题:
①若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为ml;
②该实验的主要步骤有:计算、、稀释配制、装瓶并贴标签.
③用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数20%(填“大于”、“小于”或“等于”).
 B . 向一定量的氢氧化钠和氯化钠的混合溶液中逐滴加入氯化铁溶液
B . 向一定量的氢氧化钠和氯化钠的混合溶液中逐滴加入氯化铁溶液  C . 向一定量的氢氧化钠溶液中逐滴加水稀释
C . 向一定量的氢氧化钠溶液中逐滴加水稀释 D . 向两个分别盛有质量相等的氢氧化镁和氧化镁固体的烧杯中,逐滴加入溶质质量分数相同的稀盐酸
D . 向两个分别盛有质量相等的氢氧化镁和氧化镁固体的烧杯中,逐滴加入溶质质量分数相同的稀盐酸
-
(1) 上述浓硫酸中溶剂的质量分数是.
-
(2) 要把50g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是多少?(请写出计算过程)

-
(1) 配制100g溶质质量分数为7.3%的稀盐酸,需图甲所示盐酸的质量为g。
-
(2) 将(1)中配制好的稀盐酸加人盛有石灰石样品的烧杯中,产生气体的质量与加入稀盐酸的质量关系如图乙所示(假设石灰石样品中的杂质不与稀盐酸反应)。计算:该石灰石样品中碳酸钙的质量。
-
(1) 现要配制120kg溶质质量分数为20%的食盐溶液,需要取用固体食盐kg。
-
(2) 用60kg溶质质量分数为20%的食盐溶液,可稀释成12%的食盐溶液kg。

-
(1) 这一瓶浓盐酸中溶质的质量是多少克? (结果精确到0.1 )
-
(2) 取100克此瓶内的浓盐酸可以稀释成1.85%的稀盐酸多少克?同时加水多少克?
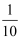 C . 增大到原来的10倍
D . 不变
C . 增大到原来的10倍
D . 不变
-
(1) 甲、乙、丙三种固体物质溶解度曲线如图所示。

①t3℃时甲、乙、丙三种固体物质的溶解度由大到小的顺序是。
②在℃时,甲、丙两种物质的溶解度相等;
③在t3℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为g。
④将t3℃等质量的甲、乙饱和溶液降温到t2℃,所得溶液中溶质的质量大小关系为甲乙(填“>”“=”“<”)。
-
(2) 氯化钠样品中常含有可溶性杂质CaCl2和MgCl2。为除去可溶性杂质,将样品溶于水,依次加入稍过量的NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X和滤液,向滤液中加入过量的稀盐酸,蒸发得氯化钠晶体。下列说法正确的是。
A滤渣X中有两种成分
B“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C将氯化钠溶液加热蒸发,至水分完全蒸干时停止加热
-
(3) 在实验室中,欲配制溶质质量分数为16%的氯化钠溶液150g,需要称量氯化钠固体的质量为g,将上述150g氯化钠溶液稀释成溶质质量分数为12%的溶液,需要加入蒸馏水的质量为g。

-
(1) 需要把10g36.5%浓盐酸稀释成14.6%稀盐酸,需要加水。
-
(2) 请计算所用氢氧化钡溶液的溶质质量分数。(请写出计算过程)
-
(3) 当加入稀盐酸质量为20g时,往溶液中滴加碳酸钠溶液,随着26.5%碳酸钠溶液的滴入,请画出溶液产生沉淀的图象。



-
(1) 太空失重状态下把泡腾片插入水球的“泡腾片实验”,蓝色的水球内产生气泡,如图 1 所示。泡腾片中的主要成分如图 2。
①泡腾片中柠檬酸发生反应:
 ,X 的化学式为 。
,X 的化学式为 。②泡腾片中维生素 C 的相对分子质量为 。 下列“天宫食品”中富含维生素 C 的是 。
a.苹果 b.酱牛肉 c.米饭
-
(2) 冰墩墩(图 3)助力天宫课堂,其内部填充物为 100%聚酯纤维,聚酯纤维属于 (填“合成”或“复合”)材料。
-
(3) 航天员在“天宫”中生活所需要的氧气来自于水的电解。化学小组按照图 4 装置进行 水的电解实验。
①电解液采用 4%的 NaOH 溶液,用 100g8%的 NaOH 溶液配制,需加水 g。
②通电一段时间后,若 B 管中收集 10mL 的气体,则 A 管内收集的气体体积约 为 mL。
-
(4) 水的净化再利用是天宫资源利用最大化的重要措施。“生命吸管”是一种户外净水装 置,(如图)下列说法正确的是____。
 A . 超滤膜可以过滤部分颗粒杂质,降低浑浊度 B . 抗菌颗粒可以去除细菌 C . 通过“生命吸管”可以得到纯净水 D . 椰壳活性炭可以消除异味、提升口感,是利用了它的吸附性
A . 超滤膜可以过滤部分颗粒杂质,降低浑浊度 B . 抗菌颗粒可以去除细菌 C . 通过“生命吸管”可以得到纯净水 D . 椰壳活性炭可以消除异味、提升口感,是利用了它的吸附性



