还原反应及其应用 知识点题库
利用能源、节约能源、保护环境是我们大家共同关注的问题.
(1)充分燃烧1000g天然气和煤所产生的CO2和SO2气体的质量如图所示,则燃烧对环境影响较小,1000g煤中硫元素的质量为 (假设硫元素完全转化为SO2).
(2)SO2的大量排放能形成酸雨,pH5.6(填写“<”、“>”或“=”)的降雨称为酸雨,在煤燃烧后将烟气通入吸收塔并“喷淋”石灰水进行“脱硫”可减少SO2的排放,石灰水需要“喷淋”的目的是 , 石灰水与SO2反应的化学方程式为 (SO2和碱反应与CO2相似).
(3)目前,在汽车尾气系统中安装催化转化器可将污染物CO,NO转化为无毒的CO2和N2 , 2CO+2NO 2CO2+N2 , 请根据“在化学反应过程中有元素化合价变化的化学反应,叫做氧化还原反应”判断,该反应(填写“是”或“不是”)氧化还原反应.
2CO2+N2 , 请根据“在化学反应过程中有元素化合价变化的化学反应,叫做氧化还原反应”判断,该反应(填写“是”或“不是”)氧化还原反应.

化学反应:2Al+Fe2O3 Al2O3+2Fe中的还原剂是( )
Al2O3+2Fe中的还原剂是( )
 Al2O3+2Fe中的还原剂是( )
Al2O3+2Fe中的还原剂是( )
A . Fe2O3
B . Al2O3
C . Al
D . Fe
电子技术离不开高纯硅,硅广泛应用于电子工业,工业上制硅的基本原理是:SiO2+2C Si+2CO↑,该反应中还原剂是 ,该反应中氧化剂是
Si+2CO↑,该反应中还原剂是 ,该反应中氧化剂是
 Si+2CO↑,该反应中还原剂是 ,该反应中氧化剂是
Si+2CO↑,该反应中还原剂是 ,该反应中氧化剂是
分析、总结、归纳,从中找出规律,是学习化学的重要方法.
-
(1) 从化合价角度分析:①C+2CuO
 2Cu+CO2↑,C由0价→+4价,化合价升高,C具有还原性,是还原剂;Cu由+2价→0价,化合价降低,CuO具有氧化性,是氧化剂.试分析:CH4+4Cl2
2Cu+CO2↑,C由0价→+4价,化合价升高,C具有还原性,是还原剂;Cu由+2价→0价,化合价降低,CuO具有氧化性,是氧化剂.试分析:CH4+4Cl2 CCl4+4HCl 中的还原剂是 ,在集气瓶口产生的“白雾”是
CCl4+4HCl 中的还原剂是 ,在集气瓶口产生的“白雾”是
-
(2) 除了物质、条件不同,分析比较这两个反应,二者的区别是:
水煤气是用水蒸气通过炽热的碳发生反应而产生的,反应原理为:H2O+C CO+H2 . 请回答下列有关问题:
CO+H2 . 请回答下列有关问题:
(1)上述反应的基本反应类型是 .
(2)在上述反应中,发生氧化反应的物质是 , 被还原的物质是 .
(3)上述反应说明单质碳具有性.
在反应3Fe+4H2O Fe3O4+4H2中.作氧化剂的是( )
Fe3O4+4H2中.作氧化剂的是( )
 Fe3O4+4H2中.作氧化剂的是( )
Fe3O4+4H2中.作氧化剂的是( )
A . Fe
B . H2O
C . Fe3O4
D . H2
置换反应是中学化学反应的基本反应类型之一.
已知:化合物A+单质B→化合物C+单质D.试回答下列问题.
-
(1) 若D为氢气,A为稀硫酸,则B应满足的条件是.
-
(2) 若D为铜,化合物A的化学式可能为.
-
(3) 已知在高温条件下碳与水蒸气可反应生成一氧化碳和氢气(水煤气的主要成分),写出该反应的化学方程式.若家中发生燃气(天然气)泄漏,下列措施不可行的是(填字母序号).
A.检查并关闭气源阀门 B.轻轻打开门窗通风.C.立即打开抽油烟机排气
-
(4) 非金属单质也具有类似金属与盐溶液之间发生置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐酸溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2、I2+Na2S═2NaI+S↓、Br2+2KI═2KBr+I2
由此判断S、Cl2、I2、Br2四种单质中非金属活动性最强的是,最弱的是.
-
(5) 在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应,据此判断置换反应(填“属于”或“不属于”)氧化还原反应.
有化合价升降的反应是氧化还原反应,下列一定不是氧化还原反应的是( )
A . 2Mg+CO2  2MgO+C
B . 2Na+2H2O=2NaOH+H2↑
C . Cl2+2NaI=2NaCl+I2
D . H2O+CO2=H2CO3
2MgO+C
B . 2Na+2H2O=2NaOH+H2↑
C . Cl2+2NaI=2NaCl+I2
D . H2O+CO2=H2CO3
 2MgO+C
B . 2Na+2H2O=2NaOH+H2↑
C . Cl2+2NaI=2NaCl+I2
D . H2O+CO2=H2CO3
2MgO+C
B . 2Na+2H2O=2NaOH+H2↑
C . Cl2+2NaI=2NaCl+I2
D . H2O+CO2=H2CO3
化学上把化合价升降的化学反应叫做氧化还原反应,化学价升高的物质叫还原剂,还原剂被氧化,化合价降低的物质叫氧化剂,氧化剂被还原.回答下列问题:
-
(1) 初中的化学反应一定属于氧化还原反应的是
A化合反应B分解反应C置换反应D复分解反应
-
(2) 化学方应C+2CuO
 2Cu+CO2↑,该反应的氧化剂是,还原剂是,这个化学反应在初中反应的基本类型是.
2Cu+CO2↑,该反应的氧化剂是,还原剂是,这个化学反应在初中反应的基本类型是.
单晶硅是制作电子集成电路的基础材料.工业上通过以下反应将自然界的二氧化硅(SiO2)转化为硅:
SiO2+2C  Si+2CO↑.下列分析正确的是( )
Si+2CO↑.下列分析正确的是( )
A . 二氧化硅发生了氧化反应
B . 碳发生了还原反应
C . 该反应属于分解反应
D . 该反应中碳是还原剂
在氧化还原反应中,得到氧的物质是还原剂;失去氧的物质是氧化剂. 有反应:2Al+Fe2O3  2Fe+Al2O3 , 此反应中还原剂是( )
2Fe+Al2O3 , 此反应中还原剂是( )
 2Fe+Al2O3 , 此反应中还原剂是( )
2Fe+Al2O3 , 此反应中还原剂是( )
A . Al
B . Fe
C . Fe2O3
D . Al2O3
已知存在“2Mg+CO2  2MgO+C”的化学反应,据此可知( )
2MgO+C”的化学反应,据此可知( )
 2MgO+C”的化学反应,据此可知( )
2MgO+C”的化学反应,据此可知( )
A . 镁在该反应中呈现还原性
B . 镁着火燃烧可用二氧化碳灭火
C . 镁在该反应中发生还原反应
D . 二氧化碳在该反应中发生氧化反应
小杰学习时获知“元素化合价发生变化(升或降)的化学反应是氧化还原反应”.据此判断下列基本反应类型一定是氧化还原反应的是( )
A . 化合反应
B . 分解反应
C . 置换反应
D . 复分解反应
有化合价升降的反应叫氧化还原反应,下列不是氧化还原反应的是( )
A . Mg+CO2  2MgO+C
B . CaO+H2O=Ca(OH)2
C . Cl2+2NaI=2NaCl+I2
D . 2Na+H2O=2NaOH+H2↑
2MgO+C
B . CaO+H2O=Ca(OH)2
C . Cl2+2NaI=2NaCl+I2
D . 2Na+H2O=2NaOH+H2↑
 2MgO+C
B . CaO+H2O=Ca(OH)2
C . Cl2+2NaI=2NaCl+I2
D . 2Na+H2O=2NaOH+H2↑
2MgO+C
B . CaO+H2O=Ca(OH)2
C . Cl2+2NaI=2NaCl+I2
D . 2Na+H2O=2NaOH+H2↑
在反应H2+CuO  Cu+H2O中,氧化剂是( )
Cu+H2O中,氧化剂是( )
 Cu+H2O中,氧化剂是( )
Cu+H2O中,氧化剂是( )
A . Cu
B . H2O
C . CuO
D . H2
下列归纳和推理正确的是( )
A . 氧化物是含氧元素的化合物,所以含氧元素的化合物一定是氧化物
B . 碳和CO具有还原性,可以还原CuO,H2也有还原性,也可以还原CuO
C . 离子是带电的粒子,所以带电的粒子一定是离子
D . 金很难生锈是因为化学性质稳定,铝也很难生锈,所以铝的化学性质也很稳定
碳与碳的化合物在工农业生产及日常生活中有广泛的用途。

-
(1) 图1是碳原子结构示意图,碳原子的最外层电子数为。
-
(2) 图2、3、4对应三种碳单质,图2单质的名称是;它们的物理性质相差很大,其原因是。
-
(3) 普通干电池采用石墨作为电极材料,是利用石墨优良的性。
-
(4) 如图5是木炭还原氧化铜的实验,实验中酒精灯火焰处加网罩,其作用是。此反应中发生还原反应的物质是。(填化学式)
实验室中模拟炼铁的原理用化学方程式表示为:

 , 下列有关说法正确的是( )
, 下列有关说法正确的是( )


 , 下列有关说法正确的是( )
, 下列有关说法正确的是( )
A . Fe2O3发生了氧化反应
B . 反应过程中剩余的CO无回收再利用价值
C . 实验过程中,可看到固体由红色变为黑色
D . 参与反应的CO与Fe2O3质量比是3:1
芯片、光导纤维在现代科技发展中有者十分重要的作用,制造芯片要用到高纯硅,制造光导纤维要用到高纯二氧化硅,利用石英砂(主要成分是二氧化硅)通过如下工艺流程可以分别制备高纯硅和商纯二氧化硅(反应中部分生成物已略去)。

-
(1) 硅是地壳中元素含量居第二位的(填“金属”或“非金属”)元素。
-
(2) 反应①的化学方程式:
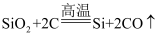 , 其中SiO2发生了。(填“氧化”或“还原”)反应。
, 其中SiO2发生了。(填“氧化”或“还原”)反应。
-
(3) 反应②和反应③都属于置换反应。工艺流程Ⅰ中可以循环利用的物质是(填化学式):工艺流程Ⅱ中反应③的化学方程式是。
钢铁是使用最多的金属材料。
-
(1) 人类向自然界提取量最大的金属是铁,高炉炼铁的原料是铁矿石、空气、石灰石和焦炭。其中焦炭的作用。
-
(2) 铝的活动性比铁强,但在生活中常在铁的表面涂上铝粉。其原因是。
-
(3) 金属钴(Co)与铁具有相似的化学性质。CoCl2固体是蓝色的,CoCl2溶液是粉红色的。现将金属钴投入稀盐酸中,发生化学反应Co + 2HCl = CoCl2 + H2↑。该反应的实验现象为。
最近更新



