常见的酸碱盐及化学肥料 知识点题库
已知:①大理石的主要成分是CaCO3 , 杂质不溶于水也不溶于酸。
②硅酸钠的化学式是Na2SiO3 , 其溶液的溶质是Na2SiO3。
③含氯废液的排放会引起地区河流和水域的污染,破坏水产业,影响人们生活,危及生态平衡。
I. “碳化法”制备纳米CaCO3

⑴固体A中加H2O的反应过程是热量(填“吸收”或“放出”)。
⑵在溶液B中加入氨水并通入气体C,则气体C是(填写化学式)。
II. 大理石抛光废渣制备纳米CaCO3

⑶“反应1”的化学方程式为。
⑷操作1和操作2都是与初中化学操作(填写:操作名称)原理相同。
⑸“大理石抛光废渣制备纳米CaCO3”废液的处理与“碳化法制备纳米CaCO3” 废液的处理相比较的优点是(写一条即可)。
⑹“反应2”发生了复分解反应,其化学方程式为。
⑺下列有关CaCO3的说法正确的是(填写字母)。
A.CaCO3是无色固体,难溶于水 B.CaCO3固体能与稀盐酸反应生成另一种盐和另一种酸
C.CaCO3固体可用于作补钙剂 D.农业上可用CaCO3与CuSO4等配制成农药波尔多液
I.取少量溶液甲于试管中,滴加酚酞溶液,观察到溶液呈红色;
II.取一定量白色固体乙于烧杯中,逐渐加入溶液甲至过量并不断搅拌,烧杯内固体的质量随加入溶液甲的质量的变化如图中折线ABC所示;

III.继续向烧杯中滴加过量的稀硝酸,搅拌,烧杯内固体的质量随加入稀硝酸质量的变化如图中CD所示;
IV.再继续向烧杯中滴加硝酸银溶液,烧杯内固体的质量随加入硝酸银溶液的质量的变化如图中DE所示。
请回答下列问题:
-
(1) 溶液甲的pH(填“小于”或“等于”、“大于”)7;
-
(2) 溶液甲中一定含有,写出步骤II所发生反应的化学方程式。
-
(3) D点时,烧杯中溶液一定含有的溶质是。
-
(4) 根据步骤IV不能确定溶液甲中某种物质一定存在,理由是。要证明甲中该物质的存在,需要补充的实验操作是。
-
(1) 晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS.该反应的微观示意图可以表示为(如图1所示):

请写出该反应的化学方程式,微粒“
 ”表示的物质属于(填“单质”或“化合物”)。
”表示的物质属于(填“单质”或“化合物”)。 -
(2) 由初中学习可知:中和反应的微观实质是氢离子和氢氧根离子结合生成了水分子,即:H++OH﹣=H2O.像这种用实际参加反应的离子符号来表示化学反应的式子叫离子方程式。离子方程式的书写一般按以下步骤(以氯化镁溶液与氢氧化钾溶液反应为例):
I.写出氯化镁溶液与氢氧化钾溶液反应的化学方程式:;
Ⅱ.把易溶于水、易电离的物质写成离子形式,难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:Mg2++2Cl﹣+2K++2OH﹣=Mg(OH)2↓+2Cl﹣+2K+;
Ⅲ.删去两边不参加反应的离子,即得离子方程式:Mg2++2OH﹣=Mg(OH)2↓。
请回答:
①如图2是碳酸钠溶液和稀盐酸反应的微观示意图,请写出该反应的离子方程式:;
②写出一个与Fe+Cu2+=Fe2++Cu相对应的化学方程式。
③下列各组离子,在pH=3的无色水溶液中能大量共存的是(填序号)。
A K+、Fe2+、Cl﹣、SO42﹣
B Na+、Ca2+、NO3﹣、OH﹣
C Na+、Ca2+、Cl﹣、CO32﹣
D NH4+、Ba2+、Cl﹣、NO3﹣
 B . 过滤
B . 过滤  C . 稀释浓硫酸
C . 稀释浓硫酸  D . 取少量固体药品
D . 取少量固体药品 

-
(1) 工业上利用液态空气法分离出氮气,其原理是因为液态氮的沸点(填“高”或“低”)于液态氧的沸点,氮气先被分离出来。
-
(2) 在煤和水蒸气反应前需先将煤粉碎,这样做的目的是。
-
(3) 气化转化器中产生的气体有CO、CO2、H2、H2O(气体),在铜催化下实现CO的转化:
 ,是利用CO的性。
,是利用CO的性。
-
(4) 合成塔①反应的化学方程式为。
-
(5) 上述流程中可以循环利用的物质有(填化学式)。

-
(1) [探究一]溶解过程中的能量变化。如图所示,同学们设计了不同的实验方案进行探究:
实验一中的硝酸铵溶解后,溶液温度(填“升高”、“降低”或“不变”)。
-
(2) 实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此得出“氢氧化钠溶于水时放出热量”的结论,你不同意此结论,写出你的理由 。
-
(3) [探究二]氢氧化钠的化学性质
如图所示,同学们用氢氧化钠进行了下列实验,请分析并回答下列问题:

①中观察到的现象是,②试管中观察到的现象是。
-
(4) ③试管中发生反应的化学方程式。
-
(5) ③④⑤试管中发生的反应属于复分解反应的是。
-
(6) 实验⑤⑥为用软矿泉水瓶所做的对比实验,装的软矿泉水瓶变瘪更明显,原因是(用化学方程式表示)
-
(7) [探究三]氢氧化钠在实验室中的应用。
①实验室中能用氢氧化钠溶液吸收的气体是(填字母序号)
a.二氧化碳
b.水蒸气
c.氯化氢
d.氧气
②吸收上述所选气体一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的不同。


-
(1) 如图②是探究物质丙组成的实验,a处为电源的极。
-
(2) 乙与戊反应的实验现象为。
-
(3) 丙与丁发生反应的化学方程式为。
-
(4) 若甲经一步反应同时生成乙和丙,则甲不可能是( )(只有一个正确选项)A . 单质 B . 氧化物 C . 酸 D . 盐

-
(1) 【进行实验】
实验步骤
实验现象
实验结论
分别用a、b、c三支试管取样,各加入一定量碳酸钠溶液
a中有气泡产生
a中物质是稀盐酸
b中无明显现象
b中物质是食盐水
c中
c中物质是澄清石灰水
写出a试管中发生反应的化学方程式。把c试管反应后的物质进行过滤,得到滤液。
-
(2) 【提出问题】滤液中溶质的成分是什么?
猜想一:Na2CO3和NaOH;猜想二:NaOH;猜想三:。
提示:Ca(OH)2微溶于水。
-
(3) 【实验过程】为证明猜想一是否正确,进行了如下实验:
实验步骤
实验现象
实验结论
取一定量滤液于试管中,加入一种盐溶液(写溶质化学式)
有白色沉淀
猜想一正确
写出上述有白色沉淀生成的化学方程式。
-
(4) 【反思与交流】a试管中的废液显酸性,从环保、经济、操作简便等方面考虑,应向废液加入(写化学式)后再排放。
-
(1) 稀盐酸、稀硫酸都能除铁锈,写出用稀硫酸除铁锈的化学方程式。
-
(2) 氢氧化钠溶液与稀硫酸反应时,溶液pH变化如图所示。

①据图判断,该实验是将滴入到另一种溶液中(填“氢氧化钠溶液”或“稀硫酸”)。
②滴入溶液体积为V2mL时,溶液中溶质为(填化学式)。
③测定某酸溶液pH时,如果放pH试纸的玻璃片上的水没有擦干就进行测定,会使测得的pH(填“偏大”或“偏小”)。
-
(3) 粗盐中常含有少量CaCl2、MgCl2、Na2SO4等杂质,将粗盐进行精制的流程如图所示:

①过量X(纯净物)溶液中溶质的化学式是。
②加入过量稀盐酸的目的可以除去滤液中过量的碳酸钠,还有一个作用是(用化学方程式表示)。
③在操作Ⅲ中玻璃棒的作用是。
-
(4) 取10g已部分变质的氢氧化钠固体样品于烧杯中,加足量水溶解;向其中加入足量的CaCl2溶液,恰好完全反应后,生成沉淀质量为5g。计算该样品中氢氧化钠的质量 。
实验 | A+B | A+C | B+C | B+D |
现象 | 溶液变红 | 溶液变红 | 产生沉淀 | 产生气体 |
-
(1) A是;B是。
-
(2) B与C发生反应的化学方程式是,写出此反应原理的一项用途。
-
(3) 写出D的一项用途。

-
(1) 沉淀池中发生反应的化学方程式为
 ,请写出X的化学式;
,请写出X的化学式;
-
(2) 从沉淀池中获得产品(NH4)2SO4的实验操作有、蒸发、洗涤、烘干等;
-
(3) 副产品的主要用途有(写一条);
-
(4) 该流程设计的优点是(写一条)。
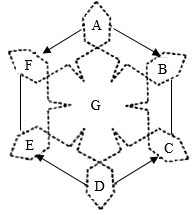
-
(1) B的化学式为。
-
(2) D→C的化学方程式可能是。
-
(3) E—F反应的基木反应类型是。
-
(4) 若G能与A反应,则G可能是____(填序号,双选)。A . Al B . SO2 C . NaOH D . CuSO4

-
(1) A 中示数变小的原因是(用化学方程式解释)。
-
(2) B 中示数(填“变大”或“变小”)。




