氨的性质及用途 知识点题库
根据下列变化进行推断,且已知强热A产生的气态物质的平均相对分子质量为26.3。

-
(1) 推断A、B、C、D的化学式:A,B,C,D。
-
(2) 写出①②变化的离子方程式:
①;
②。
-
(1) 氨气催化氧化的化学方程式为.
-
(2) 氨气若在纯氧中燃烧,则发生反应为4NH3+3O2
 2N2+6H2O,科学家利用此原理,设计成氨气﹣氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为.
2N2+6H2O,科学家利用此原理,设计成氨气﹣氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为.
-
(3) 纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为.
②用阴离子交换膜控制电解液中OH﹣的浓度制备纳米Cu2O,反应为2Cu+H2O
 Cu2O+H2↑,如图所示.该电解池的阳极反应式为.
Cu2O+H2↑,如图所示.该电解池的阳极反应式为.
重要知识点 | 主要物理性质 | 重要的化学性质 | 主要用途(至少2条) |
过氧化钠 | |||
二氧化硫 | |||
氨气 |
 B .
B .  C .
C .  D .
D . 
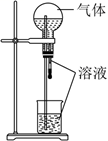
 2NH3。现用未经干燥的N2和H2按体积比V(N2):V(H2)=1:3充分混合后,按如图所示的装置进行有关实验。
2NH3。现用未经干燥的N2和H2按体积比V(N2):V(H2)=1:3充分混合后,按如图所示的装置进行有关实验。

请回答下列问题:
-
(1) 装置①中浓硫酸的作用是 。
-
(2) 若用装置②收集反应生成的气体,A应连接装置中的(填“B”或“C”);
-
(3) 收集满气体后,再用装置③进行实验,当烧瓶中的液面逐渐上升,溶液呈色。
-
(4) 实验结束时,溶液几乎充满了烧瓶,则溶液的物质的量浓度为mol/L(气体为标准状况下的体积)
-
(1) 以氨气为原料合成HNO3工艺如下,写出N2O4转化为HNO3的反应方程式。
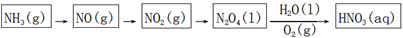
-
(2) 以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l) + CO2(g)
 NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1 反应Ⅱ:NH2COONH4(l)
 NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1 ① 已知NH3(l)
 NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)  NH2CONH2(l) + H2O(l) Δ H4=kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是。
NH2CONH2(l) + H2O(l) Δ H4=kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是。 ② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2 , 测得各组分物质的量随时间变化如图1。下列说法正确的是。
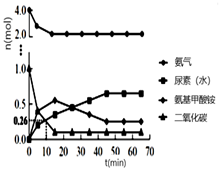
A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态
-
(3) 工业上利用氨气生产氢氰酸的反应为CH4(g) + NH3(g)
 HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0 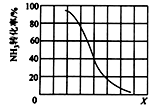
① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是(填“温度”或“压强”)。
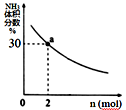
② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3 , 平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=(请写出计算过程)

-
(1) 该元素是,它位于元素周期表中第二周期、第族。
-
(2) 根据元素的化合价,从氧化还原角度分析,单质B具有的性质是。
-
(3) B、C、D、E4种物质中,属于有毒气体的是 (填化学式),欲吸收有毒气体,可选用氧气和 (填序号)。
a.氢氧化钠溶液 b.稀硫酸 c.蒸馏水
-
(4) 组装如图装置制取并收集一瓶干燥的A。

①A的化学式是。
②实验室制取A的化学方程式是。
③各装置的接口顺序是a→ (填序号)。
④X中的药品是,其作用是。
⑤检验是否收集满A的方法是。


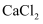 来制取氨气
B . 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明
来制取氨气
B . 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明  已经集满
C . 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D . 工业上,可以用氨气检查氯气管道是否泄漏
已经集满
C . 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D . 工业上,可以用氨气检查氯气管道是否泄漏

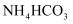 固体,观察到固体逐渐减少,试管口有液滴产生,说明
固体,观察到固体逐渐减少,试管口有液滴产生,说明  受热不稳定
C . 将红热的铂丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气红热体,说明氨气的氧化产物为
受热不稳定
C . 将红热的铂丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气红热体,说明氨气的氧化产物为  D . 如图红热的铂丝在反应过程中继续保持红热,说明该反应放热
D . 如图红热的铂丝在反应过程中继续保持红热,说明该反应放热
选项 | 性质 | 解释 |
A | 比PH3容易液化 | NH3分子间的范德华力更大 |
B | 熔点高于PH3 | N-H键的键能比P-H大 |
C | 具有还原性 | NH3中氮元素化合物为-3价 |
D | 氨水中存在 |
|

 是离子化合物
是离子化合物


