含氮物质的综合应用 知识点题库
A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:
据此判断:

-
(1) 在A、B、C这三种化合物中,必定含有乙元素的是 .(用A、B、C字母填写)
-
(2) 单质乙必定是 (填“金属“或“非金属“),其理由是
-
(3) 单质乙的分子式可能是 ,则化合物B的分子式是
火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.

-
(1) 脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
甲烷直接将NO2还原为N2的热化学方程式为.
-
(2) 脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是.
A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 , 则c1与c2的比值等于.
-
(3) 脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol•L﹣1H2SO4溶液.电极c上发生的电极反应式为,当电池中有1mole﹣发生转移时左右两侧溶液的质量之差为g (假设反应物a、b耗尽,忽略气体的溶解).

| 选项 物质 | A | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | S | SO2 | H2SO4 |
-
(1) 实验一:验证Fe2+的还原性
实验操作
预期现象
实验现象
向盛有2 mL FeSO4溶液的试管中,滴入几滴浓硝酸,振荡
试管中产生红棕色气体,溶液变为黄色
试管中产生红棕色气体,溶液变为深棕色
红棕色气体是。
-
(2) 实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明。
-
(3) 实验二:探究溶液变为深棕色的原因
(资料与猜想)
查阅资料后猜想,可能是生成的NO2或NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
(实验与探究)
用下图所示装置进行实验(气密性已检验,尾气处理已略去)

i. 关闭c,打开a和b,通入N2 , 一段时间后关闭a;
ii. 向甲中加入适量浓HNO3 , 一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
iii. 关闭
B、打开c,更换丙、丁中的溶液(试剂不变);
iv. 继续向甲中加入浓HNO3 , 一段时间后观察到了与ii相同的实验现象。
通入N2的目的是。
-
(4) 铜与浓硝酸反应的化学方程式是。
-
(5) 装置乙的作用是。
-
(6) 实验结论是。
-
(7) (反思与改进)
实验三:验证Fe2+的还原性
该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是。


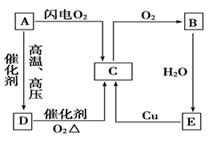
-
(1) 除去C中的B所用的试剂为
-
(2) 写出A的电子式
-
(3) 检验试管中盛装的是D的方法为
-
(4) E→C的离子方程式
-
(5) 写出实验室制备D的化学方程式
①N2→NO→NO2→HNO3→  (硝酸盐)
(硝酸盐)  N2
N2
②N2  NH3
NH3 



 N2
N2
-
(1) 通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有 3 种途径。如上① N2→NO 称为大气固氮,② N2
 NH3 称为,还有 1 种是工业固氮,其反应的化学方程式是。
NH3 称为,还有 1 种是工业固氮,其反应的化学方程式是。
-
(2) 在自然界中第①种循环是很少的,主要是第一步 N2→NO 的反应很难发生,请结合 N2的结构说明 N2→NO 的反应很难发生的原因。
-
(3) 写出氮循环①中 NO2→HNO3 的化学方程式。
-
(4) 写出氮循环②中 NH3 的电子式,其空间构型是。写出 NH
 的检验方法。
的检验方法。
-
(5) P 和N 属于周期表的族,非金属性较强的是(用元素符号表示),举一个能证明该结论的实验事实。

-
(1) 若NO(g)+1/2O2(g)=NO2(g)∆H=-58.2kJ·mol-1 , 则反应3NO(g)+O3(g)=3NO2(g)的∆H=kJ·mol-1。
-
(2) 对于反应NO(g)+O3(g)⇌NO2(g)+O2(g),在不同温度下,分别向10L的恒容密闭容器中按1:1充入一定量的NO和O3发生反应,其中NO的物质的量随时间变化如图所示:

①写出一种既能加快化学反应速率,又能增大NO转化率的方法。
②图中T1T2(填“>”“<”或“=”)。
③温度为T1时,用NO表示t1~t2s内该反应的平均速率为,该反应的平衡常数K为,若NO的起始投入量为3amol,则达到平衡时NO的残留量为mol。
-
(3) NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为。

 B .
B .  C .
C .  D .
D . 


-
(1) “球磨法”是一种基于机械化学在温和条件下由氮气合成氨的新方案,在45℃、
 条件下合成氨,氨的体积分数可达82.5%,其原理如图所示。
条件下合成氨,氨的体积分数可达82.5%,其原理如图所示。
①下列关于“球磨法”的说法正确的是。
A.铁粉碰撞活化后产生缺陷密度越大,
 的吸附率越高
的吸附率越高B.可降低氢气与氮气生成氨气的焓变,使反应更易进行
C.反应在温和条件下进行,不涉及化学键的断裂与形成
②机械碰撞有助于铁粉缺陷的形成,而摩擦生热会使体系温度升高。如图是
 吸附量、体系温度随球磨转速变化曲线,应选择的最佳转速约转/分钟;若选择500转/分钟的转速,
吸附量、体系温度随球磨转速变化曲线,应选择的最佳转速约转/分钟;若选择500转/分钟的转速, 的吸附量降低的原因是。
的吸附量降低的原因是。
-
(2) 在一种新型催化剂的作用下,用氢气催化还原
 是目前工业上去除尾气中
是目前工业上去除尾气中 较理想的方法。
较理想的方法。主反应:


副反应:


①


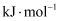
②某温度下
 的体积分数对
的体积分数对 反应的影响如图所示。当
反应的影响如图所示。当 的体积分数大于
的体积分数大于 时,
时, 的体积分数呈下降趋势,原因是。
的体积分数呈下降趋势,原因是。
-
(1) 在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。

①用装置A制备NH3 , 其中发生反应的化学方程式为;装置B内的试剂是。
②装置D中发生反应的离子方程式是,铜丝可抽动的优点是。
③在装置M中NH3和NO2充分反应,生成两种对环境友好的物质,该反应中NH3和NO2的物质的量之比为。
-
(2) 用NaOH溶液吸收法处理NOx(仅含NO、NO2)。已知过程中发生的反应有:2NaOH+NO+NO2=2NaNO2+H2O;2NaOH+2NO2=NaNO3+NaNO2+H2O
①用不同浓度的NaOH溶液吸收NO2含量不同的尾气,关系如图:

(α表示NOx中NO2的含量):
用NaOH溶液吸收氮氧化物的最佳条件为:α=,c(NaOH)=。
②若一定体积的NOx被250mL2mol·L-1的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为。
 HNO3
B . CH3CH3
HNO3
B . CH3CH3 CH2BrCH2Br
C . Fe
CH2BrCH2Br
C . Fe Fe(NO3)3 (aq)
D . 淀粉(aq)
Fe(NO3)3 (aq)
D . 淀粉(aq)  C6H12O6(葡萄糖)
C6H12O6(葡萄糖)
 B .
B .  C .
C .  D .
D . 
 C .
C .  D .
D . 



