二氧化硫的漂白作用 知识点题库
为探究SO2气体的还原性某兴趣小组设计了如装置图:
(1)证明SO2与Fe3+发生反应的现象为 ;
(2)实验中所需的SO2气体可以用浓硫酸和铜反应来制取,该反应的化学方程式为 .
(3)在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,不变红,紫色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2 , 产生白色沉淀
上述方案中不合理的是 (填数字序号),原因是 .

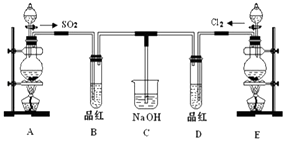
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
-
(1) 实验室用装置A制备SO2 . 某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是.
-
(2) 实验室用装置E制备Cl2 , 其反应的离子方程式为;若有6mol的HCl参加反应,则转移的电子总数为.
-
(3) 停止通气后,再给B,D两个试管分别加热,两个试管中的现象分别为B:,D:.
-
(4) 另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示).
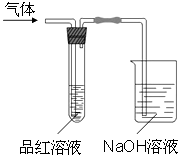
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如图所示的实验装置二套.请你参与探究并回答下列问题.
-
(1) 向第一套装置中通入一段时间的SO2 , 观察到试管中的品红溶液褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
-
(2) 向第二套装置中通入一段时间的Cl2 , 观察到试管中的品红溶液也褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
-
(3) 由以上两个实验可以说明SO2和Cl2的漂白原理(填“相同”或“不相同”);
-
(4) Cl2通入品红溶液中,生成的具有漂白性的物质是填“HCl”或“HClO”).
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

-
(1) 实验室用装置A制备SO2 . 从物质类别看,SO2属于(填“酸性”、“两性”或“碱性”)氧化物;
-
(2) 实验室用装置E制备Cl2 , 写出该反应的化学方程式:.反应中的液体反应物在反应中所表现出的性质为:;
-
(3) 反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色.停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:,D:.
-
(4) 另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样.请你分析该现象的原因(用化学方程式表示).
-
(5) C装置是尾气处理装置,写出C装置处理氯气的离子方程式.
下列说法不正确的是( )
A . 二氧化氯是一种高效安全的消毒剂
B . 沙子、石英、水晶、硅藻土等都是天然存在的二氧化硅
C . SO2能漂白品红溶液、紫色高锰酸钾溶液
D . 还原铁粉可以用作食品袋内的抗氧化剂
下列有关实验操作或现象描述正确的是( )
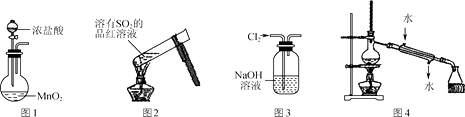
A . 实验室用图1装置制备Cl2
B . 加热后图2中溶液颜色恢复红色
C . 用图3装置除去Cl2中含有的少量HCl
D . 实验室用图4装置制取少量蒸馏水
下列实验用来证明气体SO2的存在,其中正确的( )
①能使品红溶液褪色 ②能使湿润的蓝色石蕊试纸变红 ③能使澄清的石灰水变浑浊 ④通入到足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸 ⑤通入到溴水中使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成
A . ①②④⑤
B . 都不能证明
C . ①⑤能证明
D . 只有⑤能证明
下列物质:①干燥Cl2 ②NaClO ③SO2 ④活性炭 ⑤O3 , 能使品红溶液褪色的是( )
A . ③④⑤
B . ②③④
C . ①②⑤
D . ①②③④⑤
二氯化二硫 ( S2Cl2)是一种黄红色液体,常用作橡胶的低温硫化剂和粘结剂。S2Cl2分子中各原子最外层均有8个电子。S2Cl2遇水反应会产生淡黄色沉淀和刺激性气味气体。下列说法错误的是( )
A . S2Cl2的结构式为 Cl-S –S-Cl
B . S2Cl2 可能使品红溶液褪色
C . S2Cl2 与水反应时 ,氧化产物与还原产物的物质的量之比为 1 : 3
D . 将S2Cl2气体通入 AgNO3溶液中,若有白色沉淀产生,则 S2Cl2气体中有 HCl
蔗糖与浓硫酸反应的实验改进装置如图所示。下列说法错误的是( )

A . 浓硫酸在实验过程中体现了脱水性和强氧化性
B . 可以用足量品红溶液分离两种酸性氧化物
C . 出现澄清石灰水变浑浊的现象,说明反应产生了CO2
D . 虽然改进装置能够将有毒气体吸收,但仍需按要求规范操作
根据下列实验操作和现象所得的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 浓硝酸久置于空气,颜色略显黄色 | 浓硝酸具有不稳定性 |
| B | 铜丝伸入到稀硝酸中,溶液变蓝,有气泡产生 | Cu与稀硝酸发生置换反应 |
| C | 向蔗糖中滴入浓硫酸,固体变黑膨胀 | 浓硫酸具有吸水性 |
| D | SO2通入含有酚酞的氢氧化钠溶液,溶液褪色 | SO2具有漂白性 |
A . A
B . B
C . C
D . D
向溴水中加入或通入足量下列物质,最终不能得到无色溶液的是( )
A . 二氧化硫
B . 氢氧化钠溶液
C . 碘化钾溶液
D . 热空气
实验小组设计图所示装置,验证SO2性质,对实验现象分析错误的是( )

A . 试管内Br2的CCl4溶液褪色,说明SO2具有还原性
B . 一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3
C . 试管中的红色花瓣褪色,说明SO2具有漂白性
D . 滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应
化学与生产,生活、环境等息息相关,下列说法中错误的是( )
A . “用浓酒和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是蒸馏
B . 用活性炭为糖浆脱色和用SO2漂白纸浆的原理不相同
C . 港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物
D . “玉不琢不成器”、“百炼方能成钢”发生的均为物理变化
某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去)。

回答下列问题:
-
(1) 若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是,写出NaOH溶液中发生反应的离子方程式:。
-
(2) 若溶液Y为品红溶液,气体X通过后,溶液褪色。取少量褪色后的溶液加热后恢复为红色,则气体X可能是(填化学式)。根据气体X的性质,上述实验装置应作一定的改进,则下列装置中可用来替代其尾气吸收装置的是(填序号)。

能证明SO2有漂白性的是( )
A . 酸性KMnO4溶液中通入SO2后,紫色消失
B . 品红溶液中通入SO2后,红色消失
C . 显红色的酚酞溶液通入SO2后,红色消失
D . 溴水中通入SO2气体后,橙色消失
化学在生产、生活中有着广泛的应用,下列对应关系不正确的是( )
选项 | 化学性质 | 实际应用 |
A | 乙烯能与KMnO4溶液反应 | 用浸泡过KMnO4溶液的硅土保存水果 |
B | SO2具有还原性 | 用SO2漂白纸浆和草帽 |
C | FeCl3具有氧化性 | 用FeCl3溶液刻蚀铜制印刷电路板 |
D | 长链烷烃裂解可得短链烷烃和烯烃 | 用重油裂解制备有机化工原料 |
A . A
B . B
C . C
D . D
下图是有关二氧化硫性质的实验装置图,下列说法正确的是( )

A . a中紫色石蕊先变红后褪色
B . b中品红溶液褪色,加热后又恢复红色
C . c中氢硫酸溶液出现黄色浑浊,体现 的还原性
D . d中溴水褪色,体现了二氧化硫漂白性
的还原性
D . d中溴水褪色,体现了二氧化硫漂白性
 的还原性
D . d中溴水褪色,体现了二氧化硫漂白性
的还原性
D . d中溴水褪色,体现了二氧化硫漂白性
下列物质应用和对应性质匹配的是( )
选项 | 应用 | 性质 |
A | 大型舰船的底部常镶嵌锌块,防止船底腐蚀 | 锌比铁活泼性强 |
B | 用焦炭和二氧化硅在电炉中制备粗硅 | 非金属性:C>Si |
C |
|
|
D | 聚合硫酸铁用作净水剂 | 聚合硫酸铁易溶于水 |
A . A
B . B
C . C
D . D
下列对化学知识的认识正确的是( )
A . FeO粉末在空气中受热,迅速被氧化成Fe3O4
B . 化合物与金属氧化物属于交叉关系
C . SO2可漂白纸浆,不可用于杀菌、消毒
D . 氯化钠溶于水发生电离,电离方程式为:

最近更新
 可用于漂白织物等
可用于漂白织物等


