化学能与热能的相互转化 知识点题库
如图所示,△H1=﹣393.5kJ•mol﹣1 , △H2=﹣395.4kJ•mol﹣1 , 下列说法或表示式正确的是( )

A . C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol﹣1
B . 石墨和金刚石的转化是物理变化
C . 金刚石比石墨稳定
D . 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
下列说法正确的是( )
A . H2(g)的燃烧热△H=﹣285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol
B . 反应物的总能量低于生成物的总能量时,该反应为放热反应
C . 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0
D . 已知:298 K时,N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.0 kJ/mol.在相同温度下,向密闭容器中通入0.5 mol N2和1.5 mol H2 , 达到平衡时放出46.0 kJ的热量
某反应过程中体系的能量变化如图所示,下列说法错误的是( )

A . 反应过程可表示为A+BC(反应物)→[A…B…C](过渡态)→AB+C(产物)
B . E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C . 正反应的热效应为△H=E1﹣E2 , 且E2>E1 , 所以正反应为放热反应
D . 此图中逆反应的热效应△H=E1﹣E2 , 为吸热反应
全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验 内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为的试管中铁钉锈蚀速度最慢.
②下列防止钢铁锈蚀的措施不合理的是 (填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由 腐蚀造成的.
下列说法正确的是( )
A . 凡有能量变化的过程都是化学变化
B . 吸热反应只能在加热条件下才能进行
C . 放热反应可能需要加热才能进行
D . 天然气在空气中燃烧时,其化学能将全部转化为热能
下列说法,错误的是( )
A . 人类目前所直接利用的能量大部分是由化学反应产生的
B . 煤、石油、天然气是当今世界最重要的三种化石燃料
C . 我国目前最主要的能源是煤炭
D . 人体运动所消耗的能量与化学反应无关
下列说法中正确的是( )
A . 由H原子形成1molH﹣H键要吸收热量
B . 所有燃烧反应都是放热反应
C . 在稀溶液中,1mol酸与1mol碱发生中和反应生成水时所释放的热量称为中和热
D . 凡经加热而发生的化学反应都是吸热反应
下列关于反应能量的说法正确的是( )
A . 101kPa时,2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ•mol﹣ , H2的燃烧热为571.6 kJ•mol﹣
B . Zn(s)+CuSO4(aq)=ZnSO4 (aq)+Cu(s)△H=﹣216 kJ•mol﹣ , 反应物总能量>生成物总能量
C . H+(aq)+OH﹣(aq)=H2O△H=﹣57.3 kJ•mol﹣ , 含1molNaOH的氢氧化钠的溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
D . 相同条件下,如果1molH所具有的能量为E1 , 1molH2所具有的能量为E2 , 则2 E1=E2
下面是有关化学能和热能的叙述,其中正确的是( )
A . 化学反应中不一定伴随着能量的变化
B . 只要有能量变化的过程一定是化学反应
C . 只要是加热才能发生的反应就一定是吸热反应
D . 燃烧反应都可以看成物质内部的化学能转变为热能的放热反应
实验表明,在一定条件下,乙烯和水的反应可表示为:C2H4(g)+H2O (g)=C2H5OH(g)△H=﹣45.8kJ/mol
则下列说法中正确的是( )
A . 实验中,乙烯的用量不会影响该反应的反应焓变△H
B . 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ
C . 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和
D . 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能
某化学反应过程的能量变化如图所示。下列说法正确的是( )

A . 该反应的反应物总能量高于生成物总能量
B . 使用催化剂可以增大该反应的反应热
C . 该化学反应的反应热为E1 , 且反应放热
D . 化学反应在物质变化的同时,必然伴随能量变化
常温下,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(1)∆H=-980kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-560kJ/mol
现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出252kJ的热量,则CH4与H2的物质的量之比是( )
A . 1:1
B . 1:2
C . 2:3
D . 3:2
下列说法错误的是( )
A . 化学变化一定伴随能量变化,有能量变化的过程不一定是化学变化
B . 甲烷燃烧时,化学能完全转化为热能
C . 植物燃料燃烧时放出的能量来源于太阳能
D . 旧化学键断裂所吸收的能量大于新化学键形成所放出的能量时,该反应为吸热反应
已知强酸与强碱在稀溶液里反应的中和热可表示为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,对下列反应:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ·mol-11/2,H2SO4(浓)+NaOH(aq)=1/2 Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ·mol-1,HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3 kJ·mol-1,上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是( )
A . Q2>Q3>Q1
B . Q2>Q1>Q3
C . Q1=Q2=Q3
D . Q2=Q3>Q1
如图所示,ΔH1=−393.5 kJ·mol−1 , ΔH2=−395.4 kJ·mol−1 , 下列有关说法或表示式正确的是( )
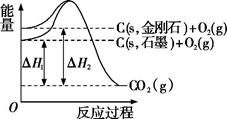
A . C(s,石墨) = C(s,金刚石) ΔH=−1.9 kJ·mol−1
B . 石墨和金刚石的转化是物理变化
C . 金刚石的稳定性比石墨的弱
D . 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
在 25 mL 1.00 mol/L HCl 溶液中逐滴加入未知浓度 NaOH 溶液 V mL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图所示。下列叙述正确的是( )

A . 做该实验时环境温度为 22℃
B . 加入 30 mLNaOH 溶液时,HCl 完全被中和
C . NaOH 溶液的物质的量浓度约为 1.0 mol/L
D . 该实验表明热能可能转化为化学能
目前认为乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )

A . 第①步反应的中间体比第②步反应的中间体稳定
B . 总反应速率由第①步反应决定
C . 第③步反应原子利用率为100%
D . 总反应为吸热反应
化学反应不仅有物质的变化还伴随能量的变化,下列说法不正确的是( )
A . 已知 , 则其逆反应的
, 则其逆反应的 一定大于0
B . 热化学方程式和化学方程式的化学计量数的意义相同
C . 常温常压下,1molS(s)完全燃烧比1molS(g)完全燃烧时的焓变大
D .
一定大于0
B . 热化学方程式和化学方程式的化学计量数的意义相同
C . 常温常压下,1molS(s)完全燃烧比1molS(g)完全燃烧时的焓变大
D . 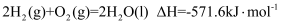 , 则
, 则
 , 则其逆反应的
, 则其逆反应的 一定大于0
B . 热化学方程式和化学方程式的化学计量数的意义相同
C . 常温常压下,1molS(s)完全燃烧比1molS(g)完全燃烧时的焓变大
D .
一定大于0
B . 热化学方程式和化学方程式的化学计量数的意义相同
C . 常温常压下,1molS(s)完全燃烧比1molS(g)完全燃烧时的焓变大
D . 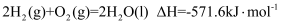 , 则
, 则
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图:

下列说法正确的是( )
A . 该能量图也可以表示碳酸氢钠与盐酸的反应过程
B . CO2所具有的能量比CO和O要高
C . 状态Ⅰ→Ⅱ的过程可以说明,形成化学键会向环境放出能量
D . 状态Ⅰ→Ⅱ→Ⅲ的过程中,反应体系经历了向环境吸收和放出能量的过程
下列说法不正确的是( )
A . 用电子式表示K2S的形成过程为: B . MgCl2和NaOH中的化学键类型完全相同,都属于离子化合物
C . CO2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D . 反应2H2O+2F2=O2+4HF,同时有极性键和非极性键的断裂和形成
B . MgCl2和NaOH中的化学键类型完全相同,都属于离子化合物
C . CO2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D . 反应2H2O+2F2=O2+4HF,同时有极性键和非极性键的断裂和形成
最近更新






