反应热的大小比较 知识点题库
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO4(s)===Cu2+(aq)+SO42- (aq) ΔH=-Q2 kJ·mol-1
(3)胆矾(CuSO4·5H2O)溶于水时溶液温度降低。则Q1与Q2的关系是(Q1、Q2为正数)( )
-
(1) 已知:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1;
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2 , 则△H1△H2
-
(2) 在298K、100kPa时,已知:
2H2(g)+O2(g)═2H2O(g)△H1
2HCl(g)═Cl2(g)+H2(g)△H2
4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H3
则△H3与△H1和△H2的关系是:△H3=
-
(3) 消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染.已知一定条件下:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1
则该条件下,用CH4还原NO2至N2的热化学方程式为:
-
(4) 乙烯是石油裂解气的主要成分之一,25℃、101kPa时,1g乙烯燃烧生成CO2气体与液态水,放出50.5kJ的热量,该反应的热化学方程式为.
(1)2H2(l)+O2(g)═2H2O(l)△H1=﹣Q1 kJ•mol﹣1
(2)2H2(g)+O2(g)═2H2O(l)△H1=﹣Q2 kJ•mol﹣1
(3)2H2(l)+O2(g)═2H2O(g)△H1=﹣Q3 kJ•mol﹣1
则Q1、Q2、Q3的关系表示正确的是( )
H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ•mol﹣1
向1L0.5mol/L的NaOH溶液中分别加入①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3、它们的关系正确的是( )
C2H5OH(l)+2O2(g)═2CO(g)+3H2O(g)△H1
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H2
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(l)△H3
C(s)+H2O(g)═CO(g)+H2(g)△H4
2C(s)+2H2O(g)═2CO(g)+2H2(g)△H5
其反应热大小关系正确的是( )
 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示: |
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述错误的是:( )

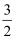 C(s)=
C(s)= 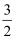 CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol, C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ/mol,
则2Fe(s)+ 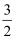 O2(g)=Fe2O3(s)的ΔH是( )
O2(g)=Fe2O3(s)的ΔH是( )

① 
② 
③ 
④ 
⑤ 
请回答下列问题:
-
(1) 过程Ⅰ的能量转化形式为:能转化为能;
-
(2) 请完成第⑤个反应的化学方程式;
-
(3) 上述转化过程中,
 和
和  的关系是;
的关系是;
-
(4) 断裂1mol化学键所需的能量见下表:
共价键




断裂1mol化学键所需能量/

393
460
941
499
 和
和  反应生成
反应生成  的热化学方程式为。
的热化学方程式为。

 B . 相同条件下,HCl的
B . 相同条件下,HCl的  比HBr的小
C . 已知HF气体溶于水放热,则HF的
比HBr的小
C . 已知HF气体溶于水放热,则HF的  D . 相同条件下,HCl的
D . 相同条件下,HCl的  比HI的大
比HI的大
①CO32-(aq)+H+(aq)=HCO3-(aq)ΔH1
②CO32-(aq)+H2O(l)  HCO3-(aq)+OH−(aq)ΔH2
HCO3-(aq)+OH−(aq)ΔH2
③OH−(aq)+H+(aq)=H2O(l)ΔH3
④OH−(aq)+CH3COOH(aq)=CH3COO−(aq)+H2O(l)ΔH4
 O2(g)=H2O(g) ΔH=akJ/mol
O2(g)=H2O(g) ΔH=akJ/mol ⑵2H2(g)+O2(g)=2H2O(g) ΔH=bkJ/mol
⑶H2(g)+  O2(g)=H2O(l) ΔH=ckJ/mol
O2(g)=H2O(l) ΔH=ckJ/mol
⑷2H2(g)+O2(g)=2H2O(l) ΔH=dkJ/mol
下列关系式中正确的是( )
 转化利用是碳治理的重要方法,有利于实现碳资源的有效循环。
转化利用是碳治理的重要方法,有利于实现碳资源的有效循环。已知:甲醇的气相标准燃烧热(焓): ;
;
氢气的标准燃烧热(焓): ;
;
 转化为
转化为 :
: 。
。
回答下列问题:
-
(1)

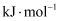 。
。
-
(2) 制备甲醇两种路径的势能图如图,根据势能图,下列说法正确的是____。
 A . 提高
A . 提高 分压一定可以提高CO2在催化剂表面的吸附速率
B . 甲酸盐路径的决速步反应是
分压一定可以提高CO2在催化剂表面的吸附速率
B . 甲酸盐路径的决速步反应是 C . 中间体
C . 中间体 比
比 更稳定
D . 使用高活性催化剂可降低反应焓变,加快反应速率
更稳定
D . 使用高活性催化剂可降低反应焓变,加快反应速率
-
(3) 研究者向恒压(3.0MPa)密闭装置中通入反应物混合气[混合比例
 ),测定甲醇时空收率随温度的变化曲线如图所示。(甲醇时空收率是表示单位物质的量催化剂表面甲醇的平均生成速率)。请解释甲醇时空收率“抛物线”前半段升高的原因:,催化剂最佳配比、最佳反应温度为。
),测定甲醇时空收率随温度的变化曲线如图所示。(甲醇时空收率是表示单位物质的量催化剂表面甲醇的平均生成速率)。请解释甲醇时空收率“抛物线”前半段升高的原因:,催化剂最佳配比、最佳反应温度为。
-
(4) 二氧化碳加氢制甲醇的速率方程可表示为
 , 其中k为速率常数,各物质分压的指数为反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用
, 其中k为速率常数,各物质分压的指数为反应级数。实验结果表明,速率常数与反应级数均受反应温度的影响。使用 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数 ,
,  反应级数不变,试计算速率常数之比
反应级数不变,试计算速率常数之比 。
。
-
(5) 在
 催化加氢制甲醇过程中存在竞争性的反应产生CO:
催化加氢制甲醇过程中存在竞争性的反应产生CO:
 , 在恒温密闭容器中,维持压强和投料不变,将
, 在恒温密闭容器中,维持压强和投料不变,将 和
和 按一定流速通过反应器,二氧化碳转化率和甲醇选择性
按一定流速通过反应器,二氧化碳转化率和甲醇选择性 随温度变化关系如图所示。若催化剂活性受温度影响不大,试分析235℃后图中两条曲线下降的原因:。
随温度变化关系如图所示。若催化剂活性受温度影响不大,试分析235℃后图中两条曲线下降的原因:。
 小于0
C . 在
小于0
C . 在 的过程中
的过程中 大于0
D .
大于0
D .  的键能
的键能 大于
大于 的键能
的键能 ,
, 与氢气反应的活性强于
与氢气反应的活性强于
-
(1) “即热饭盒”给人们生活带来方便,它可利用下面____(填字母序号)反应释放的热量加热食物。A . 生石灰和水 B . 浓硫酸和水 C . 钠和水
-
(2) 2H2 (g) + O2(g) = 2H2O(l) △H= -572 kJ/mol,该反应的能量变化可用图中的(填a或b)表示。

-
(3) 已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s) △H=﹣Q1kJ•mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s) △H=﹣Q2kJ•mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为____(填字母序号)。
A . Q1>Q2 B . Q1=Q2 C . Q1<Q2 D . 无法确定 -
(4) 已知拆开2molHCl分子中的化学键需要消耗862kJ的能量,则③、④的数值为:③kJ;④kJ。

-
(5) 已知298 K时:
C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
CO(g)+
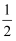 O2(g)=CO2 (g) △H2= -283.0 kJ·mol-1
O2(g)=CO2 (g) △H2= -283.0 kJ·mol-1写出C与O2反应生成CO的热化学方程式:。



