活化分子 知识点题库
改变以下反应的条件,能提高反应物活化分子百分数的是①温度 ②浓度 ③压强 ④正催化剂( )
A . ①④
B . ②③
C . ①②
D . ③④
下列说法正确的是( )
A . 活化分子间的碰撞一定是有效碰撞
B . 活化分子具有的能量是活化能
C . 活化分子的总数越多,反应速率越快
D . 单位时间内有效碰撞次数越多,反应速率越快
下列说法正确的是( )
A . 热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据
B . 升高温度和增加反应物的浓度,都使反应物活化分子数和活化分子百分数同时增加
C . 化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算
D . 物质发生化学变化不一定伴随着能量变化
一定条件下的可逆反应:2SO2(g)+O2(g)  2SO3(g),若改变下列条件,可提高反应物中的活化分子百分数的是( )
2SO3(g),若改变下列条件,可提高反应物中的活化分子百分数的是( )
 2SO3(g),若改变下列条件,可提高反应物中的活化分子百分数的是( )
2SO3(g),若改变下列条件,可提高反应物中的活化分子百分数的是( )
A . 升高温度
B . 降低温度
C . 增大压强
D . 增大反应物浓度
如图所示是25℃时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )

A . 该反应为放热反应
B . b曲线是表示加入了催化剂时的能量变化曲线
C . 加入催化剂,增加了反应的热效应
D . 反应开始通入1 mol N2和3 mol H2 , 反应后放出的热量一定为92kJ
升高温度能加快反应速率的主要原因是( )
A . 活化分子能量明显增加
B . 增加了活化分子的百分数
C . 降低了反应所需的能量
D . 改变了反应物的本身性质
改变下列一个条件,通过提高活化分子的百分率来改变反应速率的是( )
A . 增加固体反应物表面积
B . 加压
C . 加大反应物浓度
D . 加催化剂
甲醛(HCHO)是一种重要的化工产品,工业上可用甲醇脱氢法制备,相关反应方程式为:CH3OH(g)  HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
 HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
-
(1) 反应过程中需要向体系中通入空气,通过以下反应提供上述反应所需要的热量:H2(g)+
 O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol 要使反应温度维持在650℃,则进料时,甲醇和空气的体积比应为(已知空气中氧气的体积分数为20%,b>a)。
-
(2) Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH30H→・H+・CH2OH(・H叫做氢自由基,实际上就是H原子,有很高的反应活性,
“・”代表有一个单电子可以参与配对成键)
历程ii:・CH2OH→・H+HCHO
历程iii:・CH2OH→3•H+CO
历程iv:自由基发生碰撞形成新化学键而湮灭
如图1所示为在体积为2L的恒容容器中,投入1molCH3OH(g),在碳酸钠催化剂作用下开始反应,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(副反应仅考虑CH3OH
 CO+2H2):
CO+2H2):
①请在图2所给坐标中,画出历程iv的反应过程一能量变化示意图。
②下列说法合理的是。
a.升高温度,甲醇转化率提高,平衡常数变大
b.当体系气体密度保持不变时,达到平衡状态
c.及时分离产品有利于提高甲醇生成甲醛的转化率
③600℃时,前20min甲醇的平均反应速率为,此时生成甲醛的反应的Qp=(Qp的表达式与平衡常数Kp相同,p为物质的分压,分压=总压×物质的量分数,体系初始压强为P0)
④650℃以后,甲醛的选择性降低,而甲醇的转化率升高的可能原因是。
-
(3) 氧化剂可处理甲醛污染,结合以下图像分析夏季(水温约20℃)应急处理甲醛污染的水源最好应选择的试剂为。

最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )

A . •CO2经还原反应得到•COOH
B . 该研究成果将有利于缓解温室效应,并解决能源转化问题
C . 相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D . 催化剂可以改变CO2转化为CO反应的焓变
工业上研究高效处理煤燃烧释放出来的SO2 , 有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)  2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
-
(1) 已知T℃时:C(s)+
 O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=。
-
(2) 在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=,SO2的平衡转化率
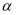 (SO2)=%;在T℃时该反应的平衡常数Kc=L/mol。
(SO2)=%;在T℃时该反应的平衡常数Kc=L/mol。 
-
(3) 实验测得:v正=v(CO)消耗=k正c(CO)•c(SO2),v逆=v(CO2)消耗=k逆
 ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),  的值将(填“增大”、“减小”或“不变”)。
的值将(填“增大”、“减小”或“不变”)。
-
(4) 某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是。

氮及其化合物的转化过程如图所示。下列分析合理的是( )

A . 催化剂a表面发生了极性共价键的断裂和形成
B . N2与H2反应生成NH3的原子利用率为100%
C . 在催化剂b表面形成氮氧键时,不涉及电子转移
D . 催化剂a、b能提高反应的平衡转化率
在恒容条件下,能使NO2(g)+CO(g)  CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:( )
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:( )
 CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:( )
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增大的措施是:( )
A . 增大NO2或CO的浓度
B . 减小CO2或NO的浓度
C . 通入Ne使气体的压强增大
D . 升高反应的温度
碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是( )
A . 分子发生碰撞就一定发生反应
B . 发生有效碰撞的分子具有最高的能量
C . 有效碰撞是活化分子在一定方向上的碰撞
D . 活化分子的平均能量称之活化能
有气体参加的反应中,能使反应物中活化分子数和活化分子百分数都增大的方法是( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
A . ①②③
B . ②③④
C . ①③④
D . ③④
在气体反应中,使反应物中活化分子数增多,且活化分子百分数增大的方法是( )
①增大反应物浓度②升高温度③增大压强④移去生成物⑤加入合适的催化剂
A . ①③⑤
B . ②⑤
C . ②③⑤
D . ①③④
下列说法正确的是( )
A . 对于有气体参与的反应,增大压强,活化分子数增多,化学反应速率增大
B . 对放热反应而言,升高温度,活化分子百分数减少,反应速率减小
C . 活化分子间发生的碰撞为有效碰撞
D . 使用催化剂,活化分子百分数增多,化学反应速率增大
一定温度下, 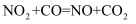 ,反应过程对应的能量变化如图,下列说法正确的是( )
,反应过程对应的能量变化如图,下列说法正确的是( )
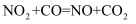 ,反应过程对应的能量变化如图,下列说法正确的是( )
,反应过程对应的能量变化如图,下列说法正确的是( ) 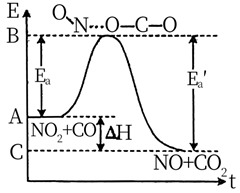
A . 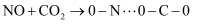 的
的 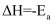 B .
B .  是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值
C . 温度升高,活化分子数增多,活化分子百分数不变,有效碰撞次数增多,反应速率增大
D . 加入催化剂可以减小
是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值
C . 温度升高,活化分子数增多,活化分子百分数不变,有效碰撞次数增多,反应速率增大
D . 加入催化剂可以减小  ,反应速率加快,
,反应速率加快,  减小
减小
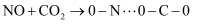 的
的 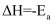 B .
B .  是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值
C . 温度升高,活化分子数增多,活化分子百分数不变,有效碰撞次数增多,反应速率增大
D . 加入催化剂可以减小
是正反应的活化能,是活化络合物的平均能量与反应物的平均能量的差值
C . 温度升高,活化分子数增多,活化分子百分数不变,有效碰撞次数增多,反应速率增大
D . 加入催化剂可以减小  ,反应速率加快,
,反应速率加快,  减小
减小
下列关于化学反应速率及化学平衡的说法,正确的是 ( )
A . 升高温度能增大单位体积内活化分子数目,加快反应速率
B . 增大反应物浓度,可增大活化分子的百分数,因而反应速率加快
C . 化学反应条件改变,已处于化学平衡的可逆反应一定发生平衡移动
D . 催化剂可以提高化学反应的选择性,进而提高反应物的平衡转化率
在化学反应中,其他条件不同,仅改变下列其中一个条件,能提高活化分子百分数的是( )
A . 增大反应物浓度
B . 增大气体反应压强
C . 加入高效催化剂
D . 增大固气反应接触面积
“人工固氮”对农业生产至关重要。在常温、常压和光照条件下,N2在某种催化剂表面与水反应的热化学方程式为2N2(g) + 6H2O(l) = 4NH3(g) + 3O2(g) ∆H,反应过程中的能量变化如图所示。下列有关说法正确的是( )

A . 该反应的焓变∆H<0
B . 升高温度,活化分子数目增多
C . 反应Ⅰ的活化能大,活化分子数目多
D . 反应Ⅱ的转化率比反应Ⅰ的转化率高
最近更新



