化学平衡移动原理 知识点题库

 N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D . 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D . 图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
-
(1) 工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g) 已知:
①H2(g)+
 O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g)
 CO(g)+3H2(g) △H4=。
CO(g)+3H2(g) △H4=。 -
(2) 工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)
 CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1 ①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是,理由;Y1Y2 (填“<”、“=”、“>”)。

②在2L恒容密闭容器中充入2molCO和4molH2 , 在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=,平衡常数Ka、Kb、Kc的大小关系:。
③下列措施既能增大反应速率又能提高反应物的转化率的是。
A.使用催化剂
B.及时分离CH3OH
C.升高温度
D.增大压强
-
(3) 已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为。

①N2(g)+O2(g)  2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)  2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)  2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是( )
 1/2N2(g)+1/2O2(g)的平衡常数为1×10-30
B . 根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C . 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D . 温度升高,上述三个反应的平衡常数均增大
1/2N2(g)+1/2O2(g)的平衡常数为1×10-30
B . 根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C . 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D . 温度升高,上述三个反应的平衡常数均增大
 2Z(g)增大压强时,对反应产生的影响是( )
2Z(g)增大压强时,对反应产生的影响是( )
 CH3OH(g)+H2O(g) ΔH = - 49.0 kJ•mol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2 , H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是( )
CH3OH(g)+H2O(g) ΔH = - 49.0 kJ•mol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2 , H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是( ) 
 2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法错误的是( )
2Z(g)ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法错误的是( ) | t/min | 2 | 4 | 10 | 15 |
| n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
 B . c(H+)·c(OH-)
C .
B . c(H+)·c(OH-)
C .  D . c(OH-)
D . c(OH-)
-
(1) x值等于
-
(2) B的平衡浓度为
-
(3) A的转化率为
-
(4) 生成D的反应速率
-
(5) 如果增大反应体系的压强,则平衡体系中C的质量分数(填“增大”或“减小”或“不变”)
 CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。 | 容器 | 起始物质的量/mol | CH4的平衡 转化率 | |||
| CH4 | H2O | CO | H2 | ||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.1 | 0.3 | / |
| Ⅲ | 0 | 0.1 | 0.2 | 0.6 | / |

下列说法错误的是( )
 H>0,图中压强p1>P2
B . 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C . 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ
D . 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5
H>0,图中压强p1>P2
B . 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C . 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ
D . 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5
反应1:C4H10(g,正丁烷)  CH4(g)+C3H6(g) △H1
CH4(g)+C3H6(g) △H1
反应2:C4H10(g,正丁烷)  C2H6(g)+C2H4(g) △H2
C2H6(g)+C2H4(g) △H2
已知几种烃的燃烧热如下:
| 烃 | 正丁烷 | 异丁烷 | 甲烷 | 乙烷 | 乙烯 | 丙烯 |
| 燃烧热(△H)/( kJ∙mol−1) | −2878 | −2869 | −890.3 | −1559.8 | −1411 | −2058.3 |
回答下列问题:
-
(1) 根据上述数据计算,△H1= kJ∙mol−1。
-
(2) 稳定性:正丁烷异丁烷(填“大于”“小于”或“等于”)。
-
(3) 在密闭容器中投入一定量的正丁烷,发生上述反应1和2,测定丁烷的平衡转化率(α)与压强(p)、温度(T)关系如图所示。

①在相同压强下,升高温度,丁烷的平衡转化率增大的原因是。
②比较压强大小:p1p2p3(填“>”“<”或“=”)。
-
(4) 某温度下,向2L恒容密闭容器中投入2mol正丁烷.假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为
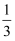 。
。 ①下列情况表明上述反应达到平衡的是(填字母,双选)。
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯体积分数保持不变
②该温度下,反应1的平衡常数K=。
 .已知该反应在25℃、80℃时的平衡常数分别为
.已知该反应在25℃、80℃时的平衡常数分别为  和2.下列说法正确的是( )
和2.下列说法正确的是( )
 的反应为吸热反应
C . 恒温恒压下,若向容器中再充入少量的Ar,上述平衡将正向移动
D . 80℃时,测得某时刻
的反应为吸热反应
C . 恒温恒压下,若向容器中再充入少量的Ar,上述平衡将正向移动
D . 80℃时,测得某时刻  、
、  浓度均为
浓度均为  ,则此时v(正)>v(逆)
,则此时v(正)>v(逆)
 的影响,且
的影响,且  。则图中纵轴表示的意义可能是( )
。则图中纵轴表示的意义可能是( ) 
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
 和
和 , 发生反应:
, 发生反应: , 在不同温度下达到化学平衡时,
, 在不同温度下达到化学平衡时, 的平衡转化率如图所示,下列说法正确的是( )
的平衡转化率如图所示,下列说法正确的是( )

 ,
,  随时间的变化如图中曲线甲所示。下列说法错误的是( )
随时间的变化如图中曲线甲所示。下列说法错误的是( )
 D . 维持温度、容积、反应物起始的量不变,向反应体系中通入一些惰性气体氩气,
D . 维持温度、容积、反应物起始的量不变,向反应体系中通入一些惰性气体氩气, 随时间变化关系如图中曲线乙所示
随时间变化关系如图中曲线乙所示



