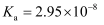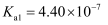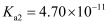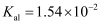з”өи§ЈиҙЁжә¶ж¶І зҹҘиҜҶзӮ№йўҳеә“
 =1Г—10-8 пјҢ дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
=1Г—10-8 пјҢ дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
еӣҫ1 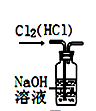 еӣҫ2
еӣҫ2  еӣҫ3
еӣҫ3 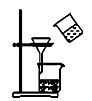 еӣҫ4
еӣҫ4 
 гҖҒCl-гҖҒ
гҖҒCl-гҖҒ  B . дҪҝз”Іеҹәж©ҷеҸҳзәўиүІзҡ„жә¶ж¶ІпјҡK+гҖҒNa+гҖҒ
B . дҪҝз”Іеҹәж©ҷеҸҳзәўиүІзҡ„жә¶ж¶ІпјҡK+гҖҒNa+гҖҒ  гҖҒ
гҖҒ  C . 0.1 mol/L FeSO4жә¶ж¶ІдёӯпјҡH+гҖҒAl3+гҖҒCl-гҖҒ
C . 0.1 mol/L FeSO4жә¶ж¶ІдёӯпјҡH+гҖҒAl3+гҖҒCl-гҖҒ  D .
D .  =0.1 mol/Lзҡ„жә¶ж¶ІдёӯпјҡNa+гҖҒ
=0.1 mol/Lзҡ„жә¶ж¶ІдёӯпјҡNa+гҖҒ  гҖҒCH3COO-гҖҒ
гҖҒCH3COO-гҖҒ 
 пјҢиӢҘе°Ҷз”ІгҖҒд№ҷдёӨеәҹж¶ІжҢүдёҖе®ҡжҜ”дҫӢж··еҗҲпјҢжҜ’жҖ§жҳҺжҳҫйҷҚдҪҺгҖӮд№ҷеәҹж¶ІдёӯеҸҜиғҪеҗ«жңүзҡ„зҰ»еӯҗжҳҜ( )
пјҢиӢҘе°Ҷз”ІгҖҒд№ҷдёӨеәҹж¶ІжҢүдёҖе®ҡжҜ”дҫӢж··еҗҲпјҢжҜ’жҖ§жҳҺжҳҫйҷҚдҪҺгҖӮд№ҷеәҹж¶ІдёӯеҸҜиғҪеҗ«жңүзҡ„зҰ»еӯҗжҳҜ( )
 е’Ң
е’Ң  B .
B .  е’Ң
е’Ң  C .
C .  е’Ң
е’Ң  D .
D .  е’Ң
е’Ң 
 B .
B . 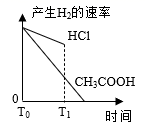 C .
C . 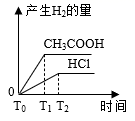 D .
D . 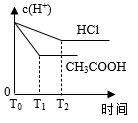
-
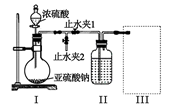
пјҲ1пјү з”Із»„еҗҢеӯҰеҲ©з”ЁдёӢеҲ—иЈ…зҪ®еҲ¶еӨҮ并收йӣҶе№ІзҮҘзҡ„ SO2пјҡ
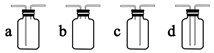
иЈ…зҪ®в… дёӯзӣӣиЈ…дәҡзЎ«й…ёй’ зҡ„д»ӘеҷЁеҗҚз§°жҳҜпјҢиЈ…зҪ® II зҡ„дҪңз”ЁжҳҜеҜ№ SO2 ж°”дҪ“иҝӣиЎҢе№ІзҮҘпјҢиҜҘиЈ…зҪ®дёӯжүҖзӣӣ иҜ•еүӮеҗҚз§°дёәпјҢиЈ…зҪ® III дёәйӣҶж°”иЈ…зҪ®пјҢеә”йҖүеҸ–еЎ«е…Ҙ III дёӯзҡ„йӣҶж°”иЈ…зҪ®дёәпјҲйҖүеЎ«еӯ—жҜҚд»ЈеҸ·пјүгҖӮ
-
пјҲ2пјү д№ҷз»„еҗҢеӯҰеҲ©з”ЁдёӢеҲ—иЈ…зҪ®еҲ¶еӨҮ SO2 并жҺўз©¶е…¶жҖ§иҙЁпјҡ
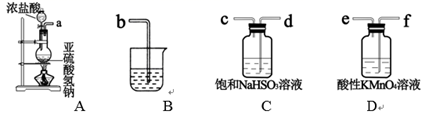
в‘ иҜҘз»„еҗҢеӯҰзҡ„е®һйӘҢиЈ…зҪ®дёӯпјҢдҫқж¬ЎиҝһжҺҘзҡ„еҗҲзҗҶйЎәеәҸдёәaвҶ’гҖӮиЈ…зҪ®CдёӯйҘұе’ҢNaHSO3жә¶ж¶Ізҡ„дҪңз”ЁжҳҜгҖӮ
в‘ЎиғҪиҜҒжҳҺSO2е…·жңүиҝҳеҺҹжҖ§зҡ„зҺ°иұЎжҳҜпјҢиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
в‘ўиЈ…зҪ®Bзҡ„дҪңз”Ёеҗёж”¶SO2е°ҫж°”пјҢиҜҘиЈ…зҪ®дёӯзӣӣиЈ…зҡ„иҜ•еүӮжҳҜгҖӮ
-
пјҲ3пјү и®ҫи®Ўе®һйӘҢиҜҒжҳҺH2SO3дёәејұз”өи§ЈиҙЁпјҡгҖӮ
-
пјҲ1пјү дёәдәҶжҸҗй«ҳз„ҷзғ§ж•ҲзҺҮпјҢйҷӨеўһеӨ§з©әж°”йҮҸеӨ–иҝҳеҸҜд»ҘйҮҮз”Ёзҡ„жҺӘж–ҪжҳҜ(еҶҷдёҖжқЎеҚіеҸҜ)пјҢеҶҷеҮәз„ҷзғ§ж—¶з”ҹжҲҗMoO3зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ2пјү вҖңжөёеҸ–"ж—¶дә§з”ҹзҡ„ж°”дҪ“AжҳҜгҖӮ
-
пјҲ3пјү иӢҘвҖңиҝҮж»ӨвҖқеүҚеҠ е…Ҙзҡ„жІүж·ҖеүӮдёәNa2SпјҢеҲҷеәҹжёЈзҡ„жҲҗеҲҶдёә(еЎ«еҢ–еӯҰејҸ)гҖӮ
-
пјҲ4пјү вҖңз»“жҷ¶вҖқеүҚйңҖеҗ‘ж»Өж¶ІдёӯеҠ е…ҘBa(OH)2 еӣәдҪ“д»ҘйҷӨеҺ»CO32-гҖӮ иӢҘж»Өж¶Ідёӯc(MoO42- )=0.40mol/LпјҢc(CO32-)=0.20mol/LпјҢиҰҒдҪҝй’је…ғзҙ ж— жҚҹеӨұпјҢCO32- зҡ„жңҖеӨ§еҺ»йҷӨзҺҮжҳҜ[е·ІзҹҘпјҡKsp(BaCO3)= 1.0Г—10-9 пјҢ Ksp(BaMoO4)=4.0Г—10-8]гҖӮ
-
пјҲ5пјү йҮҚз»“жҷ¶еҫ—еҲ°зҡ„жҜҚж¶ІеҸҜд»ҘеңЁдёӢж¬ЎйҮҚз»“жҷ¶ж—¶дәҡеӨҚдҪҝз”ЁпјҢдҪҶиҫҫеҲ°дёҖе®ҡж¬Ўж•°еҗҺеҝ…йЎ»еҮҖеҢ–еӨ„зҗҶпјҢеҺҹеӣ жҳҜгҖӮ
-
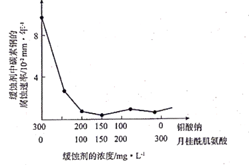
пјҲ6пјү й’јй…ёй’ е’ҢжңҲжЎӮй…°иӮҢж°Ёй…ёзҡ„ж··еҗҲж¶ІеёёдҪңдёәзўізҙ й’ўзҡ„зј“иҡҖеүӮгҖӮеёёжё©дёӢпјҢзўізҙ й’ўеңЁзј“иҡҖеүӮдёӯзҡ„и…җиҡҖйҖҹзҺҮе®һйӘҢз»“жһңеҰӮеӣҫжүҖзӨәгҖӮиҰҒдҪҝзўізҙ й’ўзҡ„зј“иҡҖж•ҲжһңжңҖеҘҪпјҢзј“иҡҖеүӮдёӯй’јй…ёй’ (ж‘©е°”иҙЁйҮҸдёәM)зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәmol/LгҖӮ
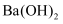 жә¶ж¶Ідёӯж»ҙеҠ (жҲ–йҖҡе…Ҙ)жҹҗзү©иҙЁXпјҢжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣеҰӮеӣҫжүҖзӨәпјҢе…¶дёӯв…©дёҚеҸҜиғҪжҳҜпјҲ пјү
жә¶ж¶Ідёӯж»ҙеҠ (жҲ–йҖҡе…Ҙ)жҹҗзү©иҙЁXпјҢжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣеҰӮеӣҫжүҖзӨәпјҢе…¶дёӯв…©дёҚеҸҜиғҪжҳҜпјҲ пјү 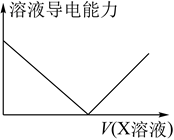
 B . зЁҖзЎ«й…ё
C . зЁҖзЎқй…ё
D .
B . зЁҖзЎ«й…ё
C . зЁҖзЎқй…ё
D . 
 гҖҒ
гҖҒ  гҖҒ
гҖҒ  гҖҒ
гҖҒ  гҖҒ
гҖҒ  гҖҒ
гҖҒ  дёӯзҡ„еҮ з§ҚзҰ»еӯҗпјҢеҸ–зӯүиҙЁйҮҸзҡ„дёӨд»ҪиҜҘеӣәдҪ“пјҢиҝӣиЎҢеҰӮдёӢе®һйӘҢ(дёҚиҖғиҷ‘зӣҗзұ»зҡ„ж°ҙи§ЈеҸҠж°ҙзҡ„з”өзҰ»)
дёӯзҡ„еҮ з§ҚзҰ»еӯҗпјҢеҸ–зӯүиҙЁйҮҸзҡ„дёӨд»ҪиҜҘеӣәдҪ“пјҢиҝӣиЎҢеҰӮдёӢе®һйӘҢ(дёҚиҖғиҷ‘зӣҗзұ»зҡ„ж°ҙи§ЈеҸҠж°ҙзҡ„з”өзҰ») в‘ҙдёҖд»ҪеӣәдҪ“жә¶дәҺж°ҙеҫ—ж— иүІйҖҸжҳҺжә¶ж¶ІпјҢеҠ е…Ҙи¶ійҮҸ  жә¶ж¶ІпјҢеҫ—жІүж·Җ4.30 gпјҢеңЁжІүж·ҖдёӯеҠ е…ҘиҝҮйҮҸзЁҖзӣҗй…ёпјҢд»Қжңү2.33 gжІүж·ҖгҖӮ
жә¶ж¶ІпјҢеҫ—жІүж·Җ4.30 gпјҢеңЁжІүж·ҖдёӯеҠ е…ҘиҝҮйҮҸзЁҖзӣҗй…ёпјҢд»Қжңү2.33 gжІүж·ҖгҖӮ
в‘өеҸҰдёҖд»ҪеӣәдҪ“дёҺиҝҮйҮҸNaOHеӣәдҪ“ж··еҗҲеҗҺе……еҲҶеҠ зғӯпјҢдә§з”ҹ  (ж ҮеҮҶзҠ¶еҶө)гҖӮ
(ж ҮеҮҶзҠ¶еҶө)гҖӮ
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 B . иҜҘеӣәдҪ“дёӯдёҖе®ҡеҗ«жңү
B . иҜҘеӣәдҪ“дёӯдёҖе®ҡеҗ«жңү  гҖҒ
гҖҒ  гҖҒ
гҖҒ  гҖҒ
гҖҒ  C . иҜҘеӣәдҪ“дёӯеҸӘеҗ«жңү
C . иҜҘеӣәдҪ“дёӯеҸӘеҗ«жңү  гҖҒ
гҖҒ  гҖҒ
гҖҒ  гҖҒ
гҖҒ  D . иҜҘеӣәдҪ“дёӯдёҖе®ҡжІЎжңү
D . иҜҘеӣәдҪ“дёӯдёҖе®ҡжІЎжңү  гҖҒ
гҖҒ  гҖҒ
гҖҒ 
| йҖүйЎ№ | е®һйӘҢж“ҚдҪңеҸҠзҺ°иұЎ | е®һйӘҢзӣ®зҡ„ |
| A | еҗ‘ж— иүІжә¶ж¶Ідёӯж»ҙеҠ FeCl3жә¶ж¶Іе’ҢCCl4 пјҢ жҢҜиҚЎгҖҒйқҷзҪ®пјҢдёӢеұӮжҳҫзҙ«зәўиүІ | иҜҒжҳҺжә¶ж¶Ідёӯеҗ«жңүI- |
| B | еҗ‘жҹҗжә¶ж¶Ідёӯе…ҲеҠ е…Ҙе°‘йҮҸж°Ҝж°ҙпјҢ然еҗҺеҠ е…ҘKSCNжә¶ж¶ІпјҢжә¶ж¶ІеҸҳдёәиЎҖзәўиүІ | иҜҒжҳҺжә¶ж¶Ідёӯеҗ«жңүFe2+ |
| C | еңЁзӣӣжңүжјӮзҷҪзІүзҡ„иҜ•з®Ўдёӯж»ҙе…Ҙ70%зҡ„зЎ«й…ёпјҢз«ӢеҲ»дә§з”ҹй»„з»ҝиүІж°”дҪ“ | иҜҒжҳҺзЎ«й…ёе…·жңүиҝҳеҺҹжҖ§ |
| D | е°Ҷ3 LSO2е’Ң1 LO2ж··еҗҲйҖҡиҝҮзҒјзғӯзҡ„V2O5е……еҲҶеҸҚеә”пјҢдә§зү©е…ҲйҖҡе…ҘBaCl2жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·ҖпјҢеҶҚйҖҡе…Ҙе“Ғзәўжә¶ж¶ІпјҢжә¶ж¶ІиӨӘиүІ | йӘҢиҜҒSO2дёҺO2зҡ„еҸҚеә”дёәеҸҜйҖҶеҸҚеә”. |
| ејұй…ё | HClO | | |
| з”өзҰ»еёёж•° пјҲ | | | |
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү
 йҖҡе…ҘNaClOжә¶ж¶Ідёӯпјҡ
йҖҡе…ҘNaClOжә¶ж¶Ідёӯпјҡ 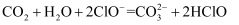 B . е°‘йҮҸ
B . е°‘йҮҸ  йҖҡе…Ҙ
йҖҡе…Ҙ 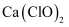 жә¶ж¶Ідёӯпјҡ
жә¶ж¶Ідёӯпјҡ 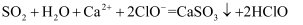 C . е°‘йҮҸ
C . е°‘йҮҸ  йҖҡе…Ҙ
йҖҡе…Ҙ  жә¶ж¶Ідёӯпјҡ
жә¶ж¶Ідёӯпјҡ 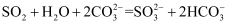 D . зӣёеҗҢжө“еәҰ
D . зӣёеҗҢжө“еәҰ  жә¶ж¶ІдёҺ
жә¶ж¶ІдёҺ  жә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҡ
жә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҡ 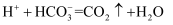
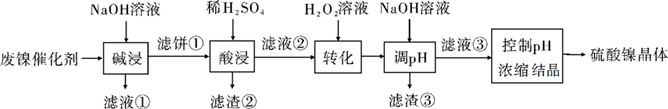
жә¶ж¶ІдёӯйҮ‘еұһзҰ»еӯҗејҖе§ӢжІүж·Җе’Ңе®Ңе…ЁжІүж·Җзҡ„pHеҰӮдёӢиЎЁжүҖзӨәпјҡ
| йҮ‘еұһзҰ»еӯҗ | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| ејҖе§ӢжІүж·Җж—¶(c=0.01 molВ·LвҲ’1)зҡ„pH | 7.2 | 3.7 | 2.2 | 7.5 |
| жІүж·Җе®Ңе…Ёж—¶(c=1.0Г—10вҲ’5 molВ·LвҲ’1)зҡ„pH | 8.7 | 4.7 | 3.2 | 9.0 |
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү вҖңзўұжөёвҖқдёӯNaOHзҡ„дёӨдёӘдҪңз”ЁеҲҶеҲ«жҳҜпјӣеҶҷеҮәNaOHдёҺAl2O3еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ2пјү вҖңж»Өж¶Ів‘ЎвҖқдёӯеҗ«жңүзҡ„йҮ‘еұһзҰ»еӯҗжҳҜгҖӮ
-
пјҲ3пјү вҖңиҪ¬еҢ–вҖқдёӯеҸҜжӣҝд»ЈH2O2зҡ„зү©иҙЁжҳҜгҖӮиӢҘе·ҘиүәжөҒзЁӢж”№дёәе…ҲвҖңи°ғpHвҖқеҗҺ вҖңиҪ¬еҢ–вҖқпјҢеҚі
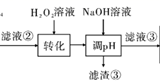 пјҢвҖңж»Өж¶Ів‘ўвҖқдёӯеҸҜиғҪеҗ«жңүзҡ„жқӮиҙЁзҰ»еӯҗдёәгҖӮ
пјҢвҖңж»Өж¶Ів‘ўвҖқдёӯеҸҜиғҪеҗ«жңүзҡ„жқӮиҙЁзҰ»еӯҗдёәгҖӮ
-
пјҲ4пјү еҲ©з”ЁдёҠиҝ°иЎЁж јж•°жҚ®пјҢи®Ўз®—Ni(OH)2зҡ„Ksp=гҖӮеҰӮжһңвҖңиҪ¬еҢ–вҖқеҗҺзҡ„жә¶ж¶ІдёӯNi2+жө“еәҰдёә1.0 molВ·LвҲ’1 пјҢ еҲҷвҖңи°ғpHвҖқеә”жҺ§еҲ¶зҡ„pHиҢғеӣҙжҳҜгҖӮ
-
пјҲ5пјү зЎ«й…ёй•ҚеңЁејәзўұжә¶ж¶Ідёӯз”ЁNaClOж°§еҢ–пјҢеҸҜжІүж·ҖеҮәиғҪз”ЁдҪңй•Қй•үз”өжұ жӯЈжһҒжқҗж–ҷзҡ„NiOOHгҖӮеҶҷеҮәиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
 зІүжң«в‘Ўй“ңв‘ўж°ҜеҢ–ж°ўв‘Ј
зІүжң«в‘Ўй“ңв‘ўж°ҜеҢ–ж°ўв‘Ј  в‘Ө
в‘Ө  еӣәдҪ“в‘Ҙ
еӣәдҪ“в‘Ҙ  еӣәдҪ“в‘ҰзәўиӨҗиүІзҡ„ж°ўж°§еҢ–й“Ғиғ¶дҪ“⑧氨ж°ҙв‘ЁзЁҖзЎқй…ёв‘©зҶ”иһҚзҡ„ж°ўж°§еҢ–й’ гҖӮ
еӣәдҪ“в‘ҰзәўиӨҗиүІзҡ„ж°ўж°§еҢ–й“Ғиғ¶дҪ“⑧氨ж°ҙв‘ЁзЁҖзЎқй…ёв‘©зҶ”иһҚзҡ„ж°ўж°§еҢ–й’ гҖӮ
-
пјҲ1пјү дёҠиҝ°зү©иҙЁдёӯпјҢеұһдәҺзӣҗзҡ„жҳҜпјӣеҸҜеҜјз”өзҡ„жҳҜпјӣеұһдәҺз”өи§ЈиҙЁзҡ„жҳҜпјӣеұһдәҺж··еҗҲзү©зҡ„жҳҜгҖӮ(еЎ«еәҸеҸ·)
-
пјҲ2пјү еҶҷеҮәв‘Өе’Ңв‘ЁеңЁж°ҙжә¶ж¶Ідёӯзҡ„з”өзҰ»ж–№зЁӢејҸпјҡгҖҒгҖӮ
-
пјҲ3пјү еҶҷеҮәв‘ўе’Ңв‘©еңЁж°ҙжә¶ж¶ІдёӯеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡгҖӮ

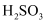
 пјү
пјү