强电解质和弱电解质 知识点题库
下列物质,属于强电解质的是( )
A . NH3•H2O
B . H2O
C . CH3COONH4
D . CH3COOH
下列属于弱电解质的是( )
A . 硅
B . 氨气
C . 醋酸
D . 氢氧化钡
下列说法正确的是( )
A . 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B . 电解质溶液的导电过程实质上是电解过程,是化学变化
C . 强电解质都是离子化合物,弱电解质都是共价化合物
D . Cl2、SO2的水溶液能导电,是电解质
下列物质中,①NaCl;②NaOH;③NH3•H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4⑨CO2;⑩酒精溶液(均填写编号回答)
-
(1) 是弱电解质的有,是非电解质的有.
-
(2) pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是.
-
(3) 有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是.
-
(4) 某温度时,1mol•L﹣1的醋酸溶液电离平衡常数为1.0×10 ﹣8 , 达平衡时,溶液中氢离子浓度是.
下列说法正确的是( )
A . 强电解质都是离子化合物,而弱电解质都是共价化合物
B . 中和pH值相等、体积相等的盐酸和醋酸,盐酸所消耗的氢氧化钠少
C . 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的1/2
D . 常温下,pH为12的溶液一定是碱溶液
20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3 , 下列说法正确的是( )
A . 酸性HY>HX
B . 结合H+的能力Y->CO  >X->HCO
>X->HCO  C . 溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
D . HX和HY酸性相同但比H2CO3弱
C . 溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
D . HX和HY酸性相同但比H2CO3弱
下列说法正确的是()
A . 硫酸钠溶液的导电过程发生了化学变化
B . 由于SiO2的分子间作用力比CO2大,导致SiO2的熔点比CO2高
C . 氢与其它元素只能形成共价化合物
D . 强电解质都是离子化合物
下列物质因发生水解而显碱性的是()
A . HCl
B . CH3COONa
C . NH4Cl
D . KOH
25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
-
(1) 写出0.1 mol·L-1一元弱酸HA的电离方程式。
-
(2) 0.1mol·L-1的H2SO4中水电离出的C(H+)为。
-
(3) 向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为;
-
(4) 向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是。
①c(H+) ②n(A-) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA)
-
(5) 实验室在配制溶液时,一些物质存在水解的情况,在配制Fe2(SO4)3溶液时,Fe3+也存在水解,请书写水解离子方程式。
请据以下物质回答下列问题(填序号)
①浓H2SO4②液态SO2③纯醋酸④硫酸氢钠固体⑤铜⑥NaOH溶液 ⑦熔融的KCl ⑧酒精
-
(1) 属于强电解的是
-
(2) 属于强电解质且在上述状态下能导电的是,属于非电解质但溶于水后能导电的是
-
(3) 写出下列物质在水中的电离方程式: 硫酸氢钠固体:醋酸:
下列说法正确的是( )
A . CaO溶于水后能导电是由于生成了Ca(OH)2 , 后者能电离产生自由移动的Ca2+、OH- , 所以CaO是非电解质
B . Pb3O4也可写成PbO·PbO2
C . 所有盐都是强电解质
D . 熔融蔗糖是非电解质
下列事实能说明H2SO3不是强电解质的是( )
①0.05mol/LH2SO3溶液的c(H+)=10-3mol/L
②相同条件下,H2SO3的导电能力比H2SO4弱
③H2SO3不稳定,易分解
④H2SO3能与碳酸钠反应制CO2
⑤H2SO3能和水以任意比例互溶
⑥1molH2SO3能够消耗2molNaOH
A . ①②⑤
B . ①②④
C . ①②③⑤
D . ①②
不能证明醋酸是弱酸的实验事实是( )
A . 常温下,0.1 mol/L CH3COOH溶液pH大于1
B . 常温下,0.1 mol/L CH3COONa溶液的pH大于7
C . CH3COOH溶液与Na2CO3反应生成CO2
D . 相同条件下,相同浓度的醋酸和盐酸与相同的Zn粒反应,盐酸反应速率快
下列说法错误的是( )
A . 常温下,向pH值相等的稀盐酸和稀硫酸中分别加入相同的金属钠,后者生成H2的速率更快
B . 将NaCl溶液从常温加热至80℃,溶液的pH变小但仍保持中性
C . 常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D . 常温下,向一定浓度的醋酸溶液中加入醋酸钠固体,溶液pH增大
按照混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的一组是( )
A . 盐酸、氯气、AgCl、CO2、SO2
B . 硫酸、氨水、醋酸、乙醇、NO2
C . 水煤气、胆矾、NH4Cl、CH3COOH、CO2
D . 干冰、氯水、HCl、HClO、CO
-
(1) 难溶物PbSO4溶于CH3COONH4溶液可制得易溶于水的(CH3COO)2Pb,发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4 , 说明(CH3COO)2Pb是(填“强”或“弱”)电解质。
-
(2) 已知次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成NaH2PO2和H2O,则次磷酸是元酸(填“一”、“二”或“三”)。
-
(3) 一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e−=Cu2+;还原反应为:2Fe3++2e−=2Fe2+。请据此将反应:Fe+2H+=Fe2++H2↑拆写成两个“半反应式”:氧化反应为;还原反应为。
-
(4) 某同学写出以下三个化学方程式(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是(填序号)。
下表中物质的分类组合完全正确的是( )
| 选项 | A | B | C | D |
| 强电解质 | 硝酸钾 | 硫酸 | 硫酸钡 | 盐酸 |
| 弱电解质 | 氟化氢 | 明矾 | 次氯酸 | 一水合氨 |
| 非电解质 | 冰水混合物 | 铝 | 二氧化硫 | 乙醇 |
A . A
B . B
C . C
D . D
-
(1) 现有以下物质:①
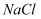 晶体 ②
晶体 ②  ③液态醋酸 ④铜 ⑤固体
③液态醋酸 ④铜 ⑤固体  ⑥纯蔗糖
⑥纯蔗糖  ⑦酒精
⑦酒精  ⑧熔融的
⑧熔融的  ⑨氨水 ⑩液氮.
⑨氨水 ⑩液氮. 请回答下列问题.(填相应序号)
上述物质能导电的是;属于非电解质的是;属于强电解质的是;写出⑧的电离方程式:.
-
(2) 一定条件下,冰醋酸加水稀释过程中溶液的导电能力如图所示

①a、b、c三点对应的溶液中,醋酸电离程度最大的是;
 最小的是.
最小的是.②在稀释过程中随着醋酸浓度的降低,下列始终保持增大趋势的量是
A.
 B.
B.  C.
C.  分子数 D.
分子数 D. 
-
(3) 已知
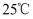 时,
时,  的电离平衡常数
的电离平衡常数  的电离平衡常数
的电离平衡常数  ,试写出下列情况下发生的离子反应方程式:
,试写出下列情况下发生的离子反应方程式: ①向
 溶液中通入少量
溶液中通入少量 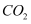 :
:②向
 溶液中滴入少量新制氯水:
溶液中滴入少量新制氯水:
回答下列问题:
-
(1) 现有①三氧化硫②澄清石灰水③液氯④纯碱⑤酒精⑥醋酸⑦稀硫酸⑧熔融的氢氧化钠等物质中,属于能导电的是,属于强电解质的是。
-
(2) 有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
①写出丙元素的元素符号。
②写出甲、乙、丙三种元素组成的化合物在水中的电离方程式。
③画出甲元素的离子结构示意图。
下列事实一定能说明CH3COOH是弱电解质的是( )
A . CH3COOH属于有机化合物
B . CH3COOH能与乙醇发生酯化反应
C . 用CH3COOH溶液做导电实验,灯泡较暗
D . 常温下,0.1mol·L-1CH3COOH溶液的pH约为3
最近更新



