离子浓度大小的比较 知识点题库
下表是不同温度下水的离子积常数:
温度/℃ | 25 | T2 |
水的离子积常数 | 1×10﹣14 | 1×10﹣12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= .此溶液中各种离子的浓度由大到小的顺序是 .
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH﹣)之比是 .
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象 ,其主要原因是(用离子方程式表示) .
(4)已知25℃时:
难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
Ksp | 8.0×10﹣16 | 8.0×10﹣38 | 1.0×10﹣17 |
用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解.当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10﹣5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果和原因是 .(lg2=0.3 lg3=0.48)
0.1mol/L的NaHCO3溶液中:
-
(1) 按物质的量浓度由大到小顺序排列该溶液中各种离子浓度
-
(2) c(Na+)+c(H+)=
-
(3) c(Na+)=
-
(4) c(OH﹣)=.
下列关于电解质溶液的叙述不正确的是( )
A . pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色
B . 在pH=3 的溶液中,Na+、Cl﹣、Fe2+、ClO﹣不能大量共存
C . 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ)
D . 向0.1mol•L﹣1的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3•H2O)减小
已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为H2RO4=H++HRO4-;HRO4-  H++RO42- 回答下列问题:
H++RO42- 回答下列问题:
 H++RO42- 回答下列问题:
H++RO42- 回答下列问题:
-
(1) NaHRO4溶液显(填“酸性”,“中性”,或“碱性”)。理由是:
-
(2) 在0.1 mol·L-1的Na2RO4溶液中,下列微粒浓度关系式正确的是: 。A . c(RO42-) +c(HRO4-)+c(H2RO4) =0.1mol·L-1 B . c(OH-)=c(H+) +c(HRO4-) C . c(Na+)+ c(H+) =c(OH-)+ c(HRO4-)+2c(RO42-) D . c(Na+)= 2c(RO42-) +2c(HRO4-)
-
(3) 如果25℃时,0.1 mol·L-1NaHRO4溶液的中,c(RO42-)=0.029 mol·L-1 则0.1 mol·L-1 H2RO4中c(RO42-)0.029 mol·L-1(填“<”,“>”,或“=”)。
-
(4) 如果25℃时,0.1 mol·L-1H2RO4溶液的中,pH=-lg0.11,则此时溶液中c(RO42-)=mol·L-1。
已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-  H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
 H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A . NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B . 常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C . 常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D . 0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
常温下,下列有关电解质溶液的说法正确的是( )
A . 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3·H2O)
B . 用少量水稀释0.1mol·L-1氨水时;溶液中  减小
C . 将Na2CO3溶液从20℃升温至30℃,溶液中
减小
C . 将Na2CO3溶液从20℃升温至30℃,溶液中  增大
D . pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
增大
D . pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
 减小
C . 将Na2CO3溶液从20℃升温至30℃,溶液中
减小
C . 将Na2CO3溶液从20℃升温至30℃,溶液中  增大
D . pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
增大
D . pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
某溶液中含有下列六种离子:①HCO3-②SO32-③K+④CO32-⑤NH4+⑥NO3- , 向其中加入稍过量Na2O2后,溶液中离子浓度基本保持不变的是()
A . ③⑥
B . ④⑥
C . ③④⑥
D . ①②⑤
在某温度时,将nmol·L-1氨水滴入10mL1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )

A . a点Kw=1.0×10-14
B . b点:c( 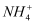 )>c(Cl-)>c(H+)>c(OH-)
C . 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D . d点水的电离程度最大
)>c(Cl-)>c(H+)>c(OH-)
C . 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D . d点水的电离程度最大
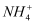 )>c(Cl-)>c(H+)>c(OH-)
C . 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D . d点水的电离程度最大
)>c(Cl-)>c(H+)>c(OH-)
C . 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D . d点水的电离程度最大
在一隔热系统中,向20.00mL0.1000mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH 溶液,测得混合溶液的温度变化如图。下列相关说法正确的是( )

A . 若a点溶液呈酸性,此时:c(CH3COO-) -c(CH3COOH) =2c (H+)-2c(OH-)
B . 从a到b:  逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
 逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
逐渐增大
C . 水的电离程度: b点<c点
D . 溶液的pH值: a 点<c点<b点
常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数 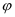 与加入盐酸的体积V的关系如图所示,下列说法错误的是( )
与加入盐酸的体积V的关系如图所示,下列说法错误的是( )
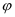 与加入盐酸的体积V的关系如图所示,下列说法错误的是( )
与加入盐酸的体积V的关系如图所示,下列说法错误的是( ) 
A . 表示NH3·H2O物质的量分数变化的曲线是A
B . NH3·H2O的电离常数为1.8×10-5mol·L-1(已知lg1.8=0.26)
C . 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D . pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法不正确的是( )

A . 当n(Cl2)<M mol时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl―
B . 当n(Cl2)=M mol时,离子浓度关系:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
C . 当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D . 当Br―开始被氧化时,通入Cl2的物质的量小于原FeBr2的物质的量
常温下,关于pH相同的氨水和氢氧化钠溶液,下列说法不正确的是( )
A . c(NH3·H2O)>c(NaOH)
B . c(NH4+)= c(Na+)= c(OH-)
C . 两种溶液中水的电离程度相同
D . 等体积的氨水和氢氧化钠溶液分别与相同浓度的盐酸完全中和时,氨水所消耗的盐酸体积多
硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
-
(1) Na2S溶液中,水的电离程度会(填“增大”“减小”或“不变”);微热该溶液,pH会(填“增大”“减小”或“不变”)。
-
(2) Na2S溶液中各离子浓度由大到小的顺序为:。
-
(3) 向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:Na2S+Na2SO3+H2SO4→Na2SO4+S
 +H2O
+H2O 配平上述化学方程式,标出电子转移的方向和数目。反应中被氧化的元素是。
-
(4) CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:
室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )

A . Ⅰ表示的是滴定盐酸的曲线
B . pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C . V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D . V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
在55℃时,下列说法正确的是( )
A . 向水中加入少量NaHSO4固体,促进水的电离,c(H+)增大,KW不变
B . pH=3的盐酸和pH=11的氨水等体积混合,溶液显碱性
C . 1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D . pH=8的NaHCO3溶液中:由水电离出的c(H+)=1×10-6mol/L
下列溶液中有关物质的量浓度关系错误的是( )
A . pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B . pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C . 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液pH=4:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D . 0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
常温下,向10.00mL 0.10 mol/L HCl和0.20 mol/L  的混合溶液中逐滴加入0. 10 mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发),且
的混合溶液中逐滴加入0. 10 mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发),且  的电离常数
的电离常数  。已知指示剂变色范围为甲基橙 (3. 1〜4. 4),酚酞(8. 2〜10. 0),下列说法错误的是( )
。已知指示剂变色范围为甲基橙 (3. 1〜4. 4),酚酞(8. 2〜10. 0),下列说法错误的是( )
 的混合溶液中逐滴加入0. 10 mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发),且
的混合溶液中逐滴加入0. 10 mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发),且  的电离常数
的电离常数  。已知指示剂变色范围为甲基橙 (3. 1〜4. 4),酚酞(8. 2〜10. 0),下列说法错误的是( )
。已知指示剂变色范围为甲基橙 (3. 1〜4. 4),酚酞(8. 2〜10. 0),下列说法错误的是( ) 
A . 测定盐酸浓度时,可选用酚酞或甲基橙作为指示剂
B . 点b处c(CH3COOH) + c(CH3COO-) = 0.2mol/L
C . 点b处溶液pH为3
D . 点c处溶液中粒子浓度大小为 

已知:25℃时,Ka(CH3COOH)=1.7×10-5 , Kb(NH3·H2O)=1.7×10-5。用0.01 mol/L的CH3COOH溶液滴定20 mL由浓度均为0.01 mol/L的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是( )

A . a点时混合溶液中:c(  )≈l.7×10-5 mol·L-1
B . b点时混合溶液中:c(CH3COOH)<c(
)≈l.7×10-5 mol·L-1
B . b点时混合溶液中:c(CH3COOH)<c(  )
C . c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c(
)
C . c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c(  )+c(NH3·H2O)+c(Na+)
D . c点时混合溶液中:pH=7
)+c(NH3·H2O)+c(Na+)
D . c点时混合溶液中:pH=7
 )≈l.7×10-5 mol·L-1
B . b点时混合溶液中:c(CH3COOH)<c(
)≈l.7×10-5 mol·L-1
B . b点时混合溶液中:c(CH3COOH)<c(  )
C . c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c(
)
C . c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c(  )+c(NH3·H2O)+c(Na+)
D . c点时混合溶液中:pH=7
)+c(NH3·H2O)+c(Na+)
D . c点时混合溶液中:pH=7
用0.1000mol/L的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.1000mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示.下列说法正确的是( )

A . 曲线①代表向盐酸中滴加 B . A点溶液的
B . A点溶液的 小于C点溶液的
小于C点溶液的 C . D点溶液中:
C . D点溶液中: D . 随着
D . 随着 溶液的加入,曲线①逐渐向②靠拢,说明电解质溶液的电导率只与离子浓度大小相关
溶液的加入,曲线①逐渐向②靠拢,说明电解质溶液的电导率只与离子浓度大小相关
 B . A点溶液的
B . A点溶液的 小于C点溶液的
小于C点溶液的 C . D点溶液中:
C . D点溶液中: D . 随着
D . 随着 溶液的加入,曲线①逐渐向②靠拢,说明电解质溶液的电导率只与离子浓度大小相关
溶液的加入,曲线①逐渐向②靠拢,说明电解质溶液的电导率只与离子浓度大小相关
25℃时,某酸(结构简式为  )溶液中含元素X物种的浓度之和为
)溶液中含元素X物种的浓度之和为 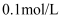 ,溶液中各含元素X物种的pX随pOH变化关系如图所示。图中
,溶液中各含元素X物种的pX随pOH变化关系如图所示。图中  ,
,  ;x、y两点的坐标:
;x、y两点的坐标:  ;
;  、
、  分别表示
分别表示  的一级、二级电离常数。下列说法错误的是( )
的一级、二级电离常数。下列说法错误的是( )
 )溶液中含元素X物种的浓度之和为
)溶液中含元素X物种的浓度之和为 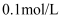 ,溶液中各含元素X物种的pX随pOH变化关系如图所示。图中
,溶液中各含元素X物种的pX随pOH变化关系如图所示。图中  ,
,  ;x、y两点的坐标:
;x、y两点的坐标:  ;
;  、
、  分别表示
分别表示  的一级、二级电离常数。下列说法错误的是( )
的一级、二级电离常数。下列说法错误的是( ) 
A .  溶液显碱性,是因为
溶液显碱性,是因为  的水解程度大于电离程度
B .
的水解程度大于电离程度
B .  溶液中,
溶液中,  C . 该体系中,
C . 该体系中,  D . z点时,
D . z点时, 
 溶液显碱性,是因为
溶液显碱性,是因为  的水解程度大于电离程度
B .
的水解程度大于电离程度
B .  溶液中,
溶液中,  C . 该体系中,
C . 该体系中,  D . z点时,
D . z点时, 
最近更新



