原子核外电子的运动状态 知识点题库
 B .
B .  C . 1s22s22p3
D .
C . 1s22s22p3
D . 

B .
B . 
C .
C . 
D .
D . 
CH3C≡N + 2 K2Cr2O7 + 6 H2SO4 = 2CO2↑ + HNO3 + 2 Cr2(SO4)2 + 2 K2SO4 + 7 H2O
-
(1) 铬基态原子的核外电子排布式为。
-
(2) CH3C≡N分子中碳原子杂化轨道类型为,1molCH3C≡N分子含
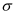 键数目为。
键数目为。
-
(3) SO
 的空间构型为;写出一种与CO2互为等电子体的分子:。
的空间构型为;写出一种与CO2互为等电子体的分子:。
-
(4) CrxZn1-xTe是由Cr2+取代了ZnTe晶胞中部分Zn2+的位置得到的一种新型稀磁半导体材料。若取代后的结构如下图所示,则x=(填数值)。

请回答与这两种物质中元素有关的一些问题。
-
(1) 基态铁原子的核外电子排布式为;基态铜原子的电子占据的最高能层符号为 。
-
(2) 氧元素的第一电离能小于氮元素,其原因是 。
-
(3) SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是;NH4+中氮原子的杂化轨道类型是。
-
(4) 写出与SO42-互为等电子体的分子的化学式 (写一种)。
-
(5) Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu 原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图) 相似,该晶体储氢后的化学式为,若该晶体的密度为ρg.cm-3 , 则晶胞中Cu原子与Au原子中心的最短距离d=cm (NA表示阿伏加德罗常数的值)。
H2S | S | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
-
(1) 基态Fe原子价层电子的电子排布图(轨道表达式)为,基态S原子电子占据最高能级的电子云轮廓图为 形。
-
(2) 根据价层电子对互斥理论,H2S,SO2 , SO3的气态分子中,中心原子价层电子对数不同于其他分子的是。
-
(3) 图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为。

-
(4) 气态三氧化硫以单分子形式存在,其分子的立体构型为形,其中共价键的类型有种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为。
-
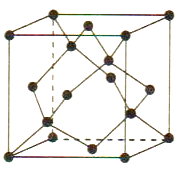
(5) FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm,FeS2相对式量为M、阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为
 ;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为 nm
;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为 nm
-
(1) X、Y、Z的电负性从大到小的顺序是 (用元素符号表示,下同)。三种元素的第一电离能由大到小的顺序为。
-
(2) 写出Y的价电子排布式,W同周期的元素中,与W原子最外层电子数相等的元素还有。
-
(3) 根据等电子体原理,可知化合物XZ的结构式是, YZ2-的VSEPR模型是。
-
(4) X、Y、Z的简单氢化物的键角从大到小的顺序是 (用化学式表示),原因是。
-
(5) Y的氢化物易液化的原因是。
-
(6) XZ32-的立体构型是,其中X原子的杂化轨道类型是,互为等电子体的离子。
-
(7) 用氢键表示式写出Z的氢化物中存在的氢键。
-
(1) FeCl3是一种常用的净水剂,氯元素的原子核外有种不同运动状态的电子;有种不同能级的电子,基态Fe3+的电子排布式为。
-
(2) 实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的
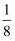 结构如图所示(K+未画出),则一个晶胞中的K+个数为 。
结构如图所示(K+未画出),则一个晶胞中的K+个数为 。 
-
(3) Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型有(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键,

乙二胺中共有个σ键,C原子的杂化方式为 。
-
(4) 金属铜的晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3 , 则铜原子的直径约为pm。
-
(5) Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。回答下列问题。某化合物的化学式为Na3CrO8 , 其阴离子结构可表示为
 ,则Cr的化合价为。CrO42-呈四面体构型,结构为
,则Cr的化合价为。CrO42-呈四面体构型,结构为  ,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为
,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为  。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为。
。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为。
-
(1) 基态铁原子核外最后一个电子填充在(填能级符号),含有个成单电子,具有磁性。
-
(2) 铁氰化钾
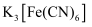 是检验
是检验  的重要试剂。
的重要试剂。 ①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为。
②铁氰化钾中,不存在(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
-
(3) 血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中
 的化合价为价,
的化合价为价,  的杂化类型是。
的杂化类型是。 
-
(4)
 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成
合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成  合金的晶体结构图。在这种结构中,同一层的
合金的晶体结构图。在这种结构中,同一层的  距离为
距离为  。
。 
①
 合金中
合金中  。
。②同一层中,
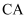 原子之间的最短距离是
原子之间的最短距离是 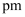 ,设
,设  为阿伏加德罗常数的值,若要求算
为阿伏加德罗常数的值,若要求算  晶体的密度,还需要知道的物理量是(钙、铜元素的相对原子质量为已知量)。
晶体的密度,还需要知道的物理量是(钙、铜元素的相对原子质量为已知量)。
①能层②能级③电子云的伸展方向④电子的自旋状态
-
(1) 基态Li原子核外电子有种不同的运动状态,占据最高能层电子的电子云轮廓图形状为 。
-
(2) Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为。
-
(3) 亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是。
-
(4) 咔唑(
 )的沸点比芴(
)的沸点比芴(  )高的主要原因是。
)高的主要原因是。
-
(5) NH3BH3 (氨硼烷,熔点104℃)与(写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为。
-
(6) 一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,原子之间的作用力是。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为。

-
(1) 上述金属中属于主族元素的有(填写元素符号)。
-
(2) 基态Fe所有电子占有种不同的空间运动状态。Fe成为阳离子时首先失去轨道电子,Fe3+的基态的核外电子排布式为。
-
(3) 钛被称为继铁、铝之后的第三金属。基态钛原子外围电子排布图为。
-
(4) 基态金原子的外围电子排布式为
 ,试判断金在元素周期表中位于第周期第族。
,试判断金在元素周期表中位于第周期第族。
-
(5) 已知
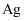 与
与  位于同一族,则
位于同一族,则 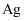 在元素周期表中位于区(填“s”“p”“d”“f”或“ds”)。
在元素周期表中位于区(填“s”“p”“d”“f”或“ds”)。
-
(6) 将乙炔通入
 溶液生成
溶液生成  红棕色沉淀。
红棕色沉淀。  基态核外电子简化排布式为。
基态核外电子简化排布式为。
-
(1) 第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为,电子占据的最高能级的电子云轮廓图为。
②根据对角线规则,Si的一些化学性质与(填短周期元素名称)相似。
-
(2) 第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:GaAs(填“大于”或“小于”,下同),第一电离能:GaAs。
②
 分子含有(填“
分子含有(填“  键”或“
键”或“  键”),As的最高价氧化物的化学式为。
键”),As的最高价氧化物的化学式为。③
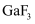 的熔点约为1000℃,
的熔点约为1000℃,  的熔点为77.9℃,其原因是。
的熔点为77.9℃,其原因是。④Ga、F、Cl的电负性由大到小的顺序为。
-
(3) 第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为
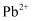 、
、  和有机碱离子
和有机碱离子 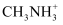 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。 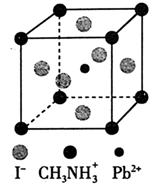
①该有机碱离子中,C、N原子的杂化轨道类型分别为、。
②若晶胞参数为apm,则晶体密度为
 。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为  ,列出计算式)
,列出计算式)
 的电子排布式
的电子排布式 , 违反了洪特规则
B . 电子云图中的小点越密表示该核外空间的电子越多
C . 基态
, 违反了洪特规则
B . 电子云图中的小点越密表示该核外空间的电子越多
C . 基态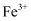 的最外层电子排布式:
的最外层电子排布式: D . 电子层数为n的能层具有的原子轨道数为
D . 电子层数为n的能层具有的原子轨道数为

-
(1) 利用一种新型高效二元铜铁催化剂,在光照条件下,将
 、
、 转化为
转化为 。
。①目前测定晶体结构可靠的科学方法是。一种铜铁催化剂的晶胞如图所示,基态
 原子的电子排布式为,该晶胞中与一个
原子的电子排布式为,该晶胞中与一个 原子相紧邻的
原子相紧邻的 原子有个。
原子有个。②在光照和铜铁催化剂条件下,基态碳原子吸收能量变为激发态原子。下列3种不同状态的碳原子轨道表示式中,能量状态最高的是(填字母)。
a.

b.

c.

-
(2) 某光电催化反应器如图所示,利用电化学原理模拟光合作用由
 制异丙醇。
制异丙醇。
①已知Ti元素的电负性为1.5,O元素的电负性为3.5,则
 、O原子之间通过键形成稳定的化合物。
、O原子之间通过键形成稳定的化合物。②
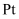 电极表面生成异丙醇的电极反应式为,此电极反应需选用高活性和高选择性的电化学催化剂,其目的是。
电极表面生成异丙醇的电极反应式为,此电极反应需选用高活性和高选择性的电化学催化剂,其目的是。



