研究物质结构的基本方法和实验手段 知识点题库
下列操作或装置能达到实验目的的是( )
A . 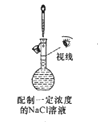 B .
B . 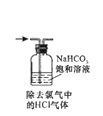 C .
C . 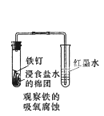 D .
D . 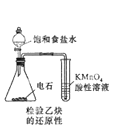
 B .
B .  C .
C .  D .
D . 
下列做法中,合乎实验操作规范的是( )
A . 将加热后的试管直接放在实验台上冷却
B . 熄灭酒精灯时,必须用灯帽盖灭
C . 为了节约药品,用剩的药品都要放回原瓶
D . 将吸有溶液的胶头滴管平放于实验台上
利用红外光谱对有机化合物分子进行测试并记录,可以判断该有机物分子拥有的( )
A . 同分异构体数
B . 原子个数
C . 基团种类
D . 相对分子量
下列说法正确的是( )
A . 制取氯乙烷(CH3一CH2Cl)的最好的方法是乙烷与氯气发生取代反应
B . 乙烯、苯都能使溴水褪色,两者的褪色原理相同
C . 2﹣丁烯不存在顺反异构体
D . 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希
乙醇和二甲醚在下列哪一种检测仪上显示出的信号是完全相同的( )
A . 质谱仪
B . 红外光谱仪
C . 元素分析仪
D . 核磁共振仪
硫酸铜的制备实验是化学实验教学中一个必做实验,某学习小组设计了如下两个实验方案:
-
(1) 实验一:
因铜不能与稀硫酸反应,实验中用铜和浓硫酸加热使之完全反应,将溶液通过蒸发、结晶等操作得到硫酸铜晶体。
根据上述实验和反应,比较浓硫酸与稀硫酸的性质,浓硫酸具有。
-
(2) 该反应的化学方程式为。
-
(3) 实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太慢,当升高温度到80~90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
Fe2(SO4)3的作用是。
-
(4) 得到的混合液可以用下列四种物质中的 调节溶液的pH =2~4,使Fe3+ 形成Fe(OH)3沉淀而除去:A . NaOH B . CuO C . CuCO3 D . Fe
-
(5) 请根据以上内容,对这两个实验方案进行评价,填下表:
实 验 (一)
实 验 (二)
主要优点
操作简便
⑴原料充分转化为产品
⑵没有有害气体排放
主要缺点
下列说法不正确的是( )
A . Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜
B . “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
C . “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用
D . 除去干燥CO2中混有的少量SO2 , 可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
下列有关光谱的说法中不正确的是( )
A . 原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光(辐射),这也是原子光谱产生的原因
B . 原子光谱只有发射光谱
C . 通过原子光谱可以发现新的元素
D . 通过光谱分析可以鉴定某些元素
下列基本实验操作中,不合理的是( )
A . 配制一定物质的量浓度溶液,向容量瓶加水至离刻度线1~2cm时,改用胶头滴管定容
B . 可用湿润的pH试纸检验氨气
C . 用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子
D . 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
下列说法中,不正确的是( )
A . 光谱分析可用于元素检测,稀有气体He就是在分析太阳光谱时发现的
B . X射线衍射实验是区别晶体与非晶体的最科学的方法
C . 等电子体具有相同的价电子总数,导致它们具有相同的化学性质
D . 分子中只含极性键的分子不一定是极性分子。
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是( )
A . 确定化学式→确定实验式→确定结构式→分离、提纯
B . 分离、提纯→确定化学式→确定实验式→确定结构式
C . 分离、提纯→确定结构式→确定实验式→确定化学式
D . 分离、提纯→确定实验式→确定分子式→确定结构式
已知某种有机物A的质谱图和红外光谱图如下:
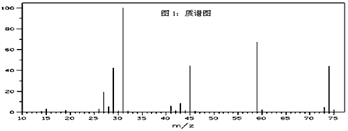

回答下列问题:
-
(1) 结合以上谱图推断:有机物A的相对分子质量为,分子式为 ,有机物A的核磁共振氢谱图中有种吸收峰,峰面积之比为。该有机物与氢氧化钠溶液在加热条件下反应的化学方程式为:。
-
(2) 直链烃B的相对分子质量比A小4,含2个甲基,并能使溴的四氯化碳溶液褪色,写出B所有可能的结构简式:、。
-
(3) 链烃C是B的同系物,且其对乙烯的相对密度为3,C的核磁共振氢谱显示:C中只含有一种氢原子。则C在一定条件下发生聚合反应的方程式为:。
尼泊金酯是国际上公认的广谱性高效防腐剂,被广泛应用于食品、医药和化妆品的防腐等领域。我国国标规定,尼泊金酯中的乙酯、丙酯可用于食品。尼泊金丙酯(其相对分子质量约为180)在酸性条件下水解可生成两种有机物A和B。A的红外光谱表征到了羧基、羟基和苯环的存在,核磁共振氢谱表明其有4种不同化学环境的氢原子,且峰面积比为1:2:2:1。
-
(1) 尼泊金丙酯中的含氧官能团的名称为。
-
(2) 为确定B的结构,可采用下列方法中的(填序号)。
a. 质谱法
b. 核磁共振氢谱法
c. 检验能否与NaHCO3溶液反应生成CO2
d. 检验能否发生氧化反应,并最终被氧化成羧酸
-
(3) 写出A与足量NaOH溶液反应的化学方程式:。
-
(4) 尼泊金乙酯的同分异构体中,满足下列条件的共有种。
a. 分子中苯环上有两个对位取代基
b. 属于酯类
c. 可与浓溴水发生取代反应
写出这些同分异构体中,不含甲基的有机物的结构简式。
下列叙述正确的是( )
A . 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有
B . 同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同
C . 原子结构模型演变历史可以表示为:  D . 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素
D . 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素
 D . 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素
D . 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素
根据相关物质结构理论,回答下列问题:
-
(1) 以下列出的是一些原子的2p能级和3d能级中电子排布图及Sc的电子排布式。试判断,违反了泡利原理的是,违反了洪特规则的是,违反了能量最低原理的是。
①
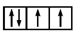 ②
② 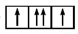 ③
③  ④
④  ⑤(21Sc)1s22s22p63s23p63d3
⑤(21Sc)1s22s22p63s23p63d3 -
(2) 某种原子的结构示意图为
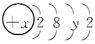 。则该原子的核电荷数x取值范围为。
。则该原子的核电荷数x取值范围为。
-
(3) 铁元素常见的离子有Fe2+和Fe3+ , 稳定性Fe2+Fe3+(填“大于”或“小于”),原因是。
有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2。
已知⑴C分子的质谱图如图所示:
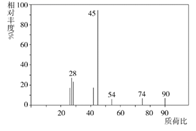
⑵C与新制Cu(OH)2悬浊液作用生成砖红色沉淀;
⑶C分子的核磁共振氢谱有5个峰,峰面积之比是1∶1∶1∶2∶1。(多个羟基连在同一个C上的结构不稳定)。
下列说法错误的是( )
A . 有机物C中含有C,H,O三种元素
B . 有机物C的分子式为C3H6O3
C . 有机物C属于糖类物质
D . 0.1molC与足量Na反应,产生H2的体积是2.24L
下列关于原子结构的说法不正确的是( )
A . 原子光谱上的特征谱线可用于元素鉴定
B . 同一原子中,2p、3p、 4p电子的能量依次增强
C . 日常生活中的焰火、LED灯都与原子核外电子跃迁释放能量有关
D . 在同一能层上运动的电子,其自旋方向肯定不同
海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式包裹在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,则融化后的水为淡水。用NA表示阿伏加德罗常数的值,设冰的密度为0.9g/cm3。下列叙述正确的是( )

A . 海冰内层“盐泡”越少,密度越大
B . 海冰冰龄越短,内层的“盐泡”越少
C . 冰的密度比水小是因为在固态冰中水分子间以氢键结合,排列更规整
D . 每含1mol H2O的海冰内就有2×105 NA个NaCl分子
许多元素及它们的化合物在科学研究和工业生产中具有多种用途。请回答下列有关问题:
-
(1) 现代化学中,常利用上的特征谱线来鉴定元素。
-
(2) 某同学画出的基态碳原子的核外电子排布图为
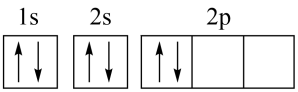 , 该电子排布图背了。CH
, 该电子排布图背了。CH 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 、CH
、CH 的空间构型分别为、。
的空间构型分别为、。
-
(3) 咪唑的结构为
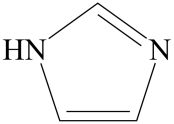 。分子中的大π键可用符号π
。分子中的大π键可用符号π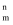 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π )。咪唑分子中的大π键可表示为,咪唑比环戊烯C5H8熔点高的主要原因是。
)。咪唑分子中的大π键可表示为,咪唑比环戊烯C5H8熔点高的主要原因是。
-
(4)
 中孤电子对与π键比值为,碳原子的杂化方式为。
中孤电子对与π键比值为,碳原子的杂化方式为。
-
(5) 铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3 , 阿伏加德罗常数为NA。
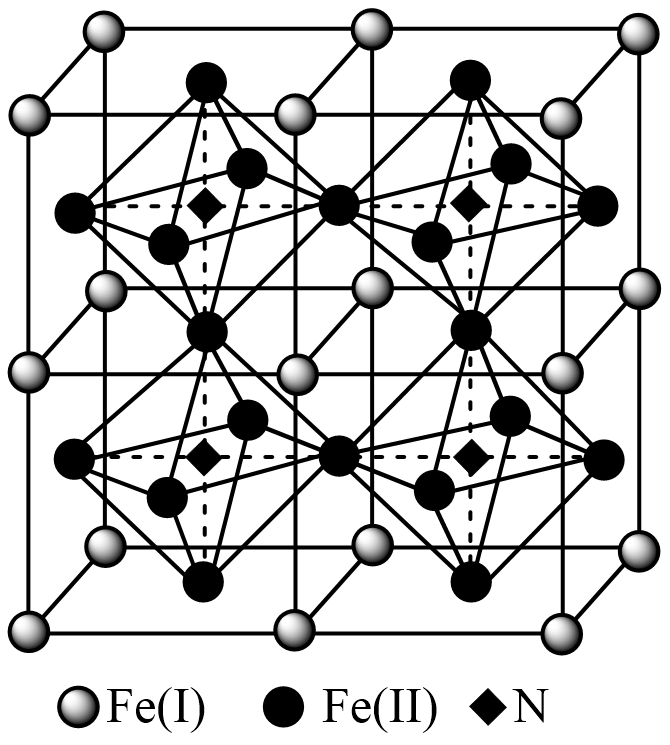
①写出氮化铁中铁的堆积方式为。
②该化合物的化学式为。
③计算出Fe(II)围成的八面体的体积为cm3。
类推是化学学习和研究中常用的思维方法,下列类推正确的是( )
A .  的空间结构为V形,故
的空间结构为V形,故 的VSEPR模型也是V形
B .
的VSEPR模型也是V形
B .  的热稳定性比
的热稳定性比 的弱,则
的弱,则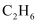 的热稳定性比
的热稳定性比 的弱
C .
的弱
C .  的溶解度比
的溶解度比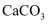 的大,则
的大,则 的溶解度比
的溶解度比 的大
D .
的大
D .  的熔点低于
的熔点低于 , 可推知
, 可推知 的熔点低于
的熔点低于
 的空间结构为V形,故
的空间结构为V形,故 的VSEPR模型也是V形
B .
的VSEPR模型也是V形
B .  的热稳定性比
的热稳定性比 的弱,则
的弱,则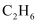 的热稳定性比
的热稳定性比 的弱
C .
的弱
C .  的溶解度比
的溶解度比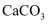 的大,则
的大,则 的溶解度比
的溶解度比 的大
D .
的大
D .  的熔点低于
的熔点低于 , 可推知
, 可推知 的熔点低于
的熔点低于
最近更新



