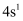物质的结构与性质之间的关系 知识点题库
-
(1) CH4和CO2所含的三种元素电负性从小到大的顺序为___ __。
-
(2) 下列关于CH4和CO2的说法正确的是_ _(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
-
(3) 在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2.
①基态Ni原子的电子排布式为 __,该元素位于元素周期表的第 _族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有 _molσ键。
-
(4)
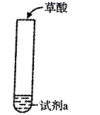
一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
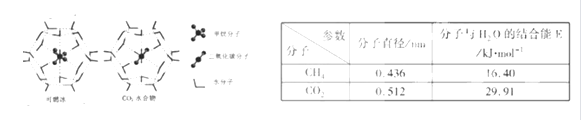
①“可燃冰”中分子间存在的2种作用力是_ _。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是 。
-
(1) 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为 .
(2)写出基态Cu+的核外电子排布式 .
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为 .
(4)写出与CO互为等电子体的离子 .(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 .
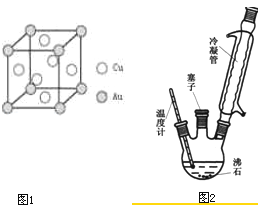
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
-
(2)
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是 .
(2)步骤②中采用油浴加热,下列说法正确的是 (填序号).
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是 .
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先 ,然后 ,以防倒吸.
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是 .每次抽滤后均应将母液收集起来,进行适当处理,其目的是
请回答下列问题:
-
(1) 与氧同周期的相邻元素中,第一电离能由大到小的顺序为.
-
(2) 臭鼬排放的臭气主要成分为3﹣MBT(3﹣甲基﹣2﹣丁烯硫醇,结构如图1).

1mol3﹣MBT中含有σ键数目为(NA为阿伏加德罗常数的值).沸点:3﹣MBT(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是.
-
(3) S有+4和+6两种价态的氧化物.
下列关于气态SO3和SO2的说法中正确的是(填选项字母).
A.中心原子的价层电子对数目相等
B.都是极性分子
C.中心原子的孤对电子数目相等
D.都含有极性键
②SO3分子的空间构型为,与其互为等电子体的阴离子为(举一例).将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图2,此固态SO3中S原子的杂化轨道类型是.
-
(4) 元素X与硒同周期,X元素原子核外未成对电子数最多,X为(填元素符号),X的基态原子的电子排布式为.
-
(5) 单质钋是由键形成的晶体;若已知Po的摩尔质量为Mg•mol﹣1 , 原子半径为r pm,阿伏加德罗常数的值为NA , 则钋晶体的密度的表达式为 g/cm3 .
治癌药Pt(NH3)2Cl2具有两种异构体,棕黄色者μ>0,淡黄色者μ=0.
①试在方框内画出两种异构体的空间构型图:
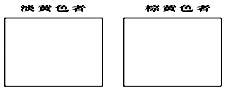
②该化合物的两种异构体在水中溶解度较大的是(填“棕黄色者”或“淡黄色者”),理由是.
 )中的D原子发生氢交换。又知次磷酸(
)中的D原子发生氢交换。又知次磷酸(  )也可跟
)也可跟  进行氢交换,但次磷酸钠(
进行氢交换,但次磷酸钠(  )却不能跟
)却不能跟  发生氢交换。由此可推断出
发生氢交换。由此可推断出  的分子结构是( )
的分子结构是( ) 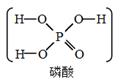
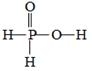 C .
C . 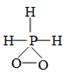
 D . 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
D . 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如下。

-
(1) 基态碳原子的价电子排布图为 。
-
(2) 1 mol HCOOH中含有的σ键数目为,HCOOH的沸点比CO2高的原因为 。
-
(3) Ru络合物中第二周期元素的第一电离能由大到小的顺序为
-
(4) Ru络合物中与Ru配位的原子有N、。
-
(5) Ru络合物含有的片段
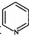 和
和  中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是(填“前者”或“后者”)。
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是(填“前者”或“后者”)。
-
(6) -种类石墨的聚合物半导体g-C3N4 , 其单层平面结构如图1,晶胞结构如图2。
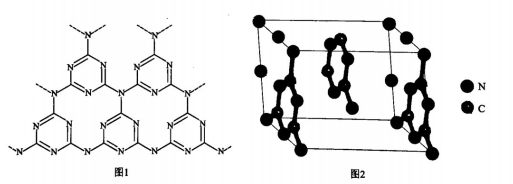
①g-C3N4中氮原子的杂化类型是。
②根据图2,在图1中用平行四边形画出一个最小重复单元。
③已知该晶胞的体积为Vcm3 , 中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA , 则g-C3N4的密度为g.cm-3。
2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料
Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发
射的设计和应用提供一个新的有效策略。
-
(1) 基态Sn原子价层电子的空间运动状态有种,基态氧原子的价层电子排布式不能表示为
 ,因为这违背了原理(规则)。
,因为这违背了原理(规则)。
-
(2) [B(OH)4] -中氧原子的杂化轨道类型为,[B(OH)4] -的空间构型为。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是。
a.
 键 b.σ键 c.配位键 d.极性键
键 b.σ键 c.配位键 d.极性键 -
(3) 碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是(填化学式),其原因是。
-
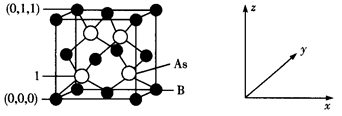
(4) 超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为。已知阿伏加德罗常数的值为NA , 若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为g·cm-3(列出含a、NA的计算式即可)。
 晶体熔点高、硬度大;
晶体熔点高、硬度大;  晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中
晶体可用于制造光导纤维
B . 碘晶体中的I-I键能较小;晶体碘沸点低、易升华
C . 在金刚石和硅晶体中,原子间通过共价键形成空间网状结构;金刚石和硅晶体类型相同
D . NaCl晶体中  与
与  个数比为1:1,CsCl晶体中
个数比为1:1,CsCl晶体中  与
与  个数比也为1∶1,NaCl和CsCl的晶胞结构相同
个数比也为1∶1,NaCl和CsCl的晶胞结构相同
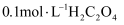 的
的 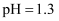 )
) | 实验 | 装置 | 试剂a | 现象 |
| ① | | Ca(OH)2溶液(含酚酞) | 产生气泡 |
| ② | 少量NaHCO3溶液 | 紫色溶液褪色 | |
| ③ | 酸性KMnO4溶液 | 溶液褪色,产生白色沉淀 | |
| ④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
下列离子方程式或化学方程式错误的是( )
 B . 草酸的酸性大于碳酸:
B . 草酸的酸性大于碳酸: 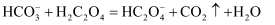 C . 草酸有还原性:
C . 草酸有还原性: 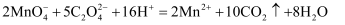 D . 草酸可发生酯化反应:HOOCCOOH+2C2H5OH
D . 草酸可发生酯化反应:HOOCCOOH+2C2H5OH 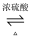 C2H5OOC-COOC2H5+2H2O
C2H5OOC-COOC2H5+2H2O
-
(1) 钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①基态钒原子的价电子排布式为。
②
 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示: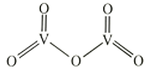
则
 分子中σ键和π键数目之比为。
分子中σ键和π键数目之比为。 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 与
与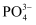 的空间构型相同,其中V原子的杂化方式为。
的空间构型相同,其中V原子的杂化方式为。 -
(2) ①科学研究表明用
 作光催化剂可处理废水中的
作光催化剂可处理废水中的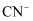 , 则
, 则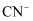 的电子式为。
的电子式为。②
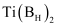 是一种储氢材料。基态B原子核外电子的运动状态有种。
是一种储氢材料。基态B原子核外电子的运动状态有种。 -
(3) 甘氨酸亚铁络合物[
 ]广泛用于缺铁性贫血的预防和治疗。
]广泛用于缺铁性贫血的预防和治疗。①
 中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。
中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。②甘氨酸 (
 )的沸点比相对分子质量相近的烷烃大很多,原因是。
)的沸点比相对分子质量相近的烷烃大很多,原因是。
 可用作食品添加剂
B . 氮的固定是将
可用作食品添加剂
B . 氮的固定是将 转化成含氮的化合物
C . 过量Fe和
转化成含氮的化合物
C . 过量Fe和 在加热条件下反应生成
在加热条件下反应生成 D . 浓硝酸一般保存在棕色试剂瓶中,并放置在阴凉处
D . 浓硝酸一般保存在棕色试剂瓶中,并放置在阴凉处
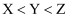 C . X与Y不可能组成化合物
C . X与Y不可能组成化合物 D . W的价电子排布为
D . W的价电子排布为