晶格能的应用 知识点
晶格能的应用 知识点题库
 Cl2(g)═NaCl(s);△H1
C . Na(s)═Na(g);△H2
D . Na(g)﹣e﹣═Na+ (g);△H
Cl2(g)═NaCl(s);△H1
C . Na(s)═Na(g);△H2
D . Na(g)﹣e﹣═Na+ (g);△H
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是 .
A.Na﹣(g)+Cl﹣(g)═NaCl(s);△H
B.Na﹣(s)+ Cl2(g)═NaCl(s);△H1
Cl2(g)═NaCl(s);△H1
C.Na(s)=Na(g);△H2
D.Na(g)﹣e﹣=Na﹣(g);△H3
E. Cl2(g)=Cl(g);△H4
Cl2(g)=Cl(g);△H4
F.Cl(g)+e﹣=Cl(g);△H5
②写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式
(2)可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2min后,测得容器中A的浓度为x mol•L﹣1 , 这时C的浓度为
①Al原子和N原子的未成对电子数
②Ag+、Cu2+与NH3形成配合物时的配位数
③NaCl的晶格能与MgO的晶格能
④F元素和O元素的电负性
⑤N元素和O元素的第一电离能
⑥H原子和H+离子的半径.
-
(1) 下列元素或化合物的性质变化顺序正确的是( )A . 第一电离能:Cl>S>P>Si B . 共价键的极性:HF>HCl>HBr>HI C . 晶格能:NaF>NaCl>NaBr>NaI D . 热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
-
(2) 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:①CuFeS2中存在的化学键类型是。下列基态原子或离子的价层电子排布图正确的是(填标号)。
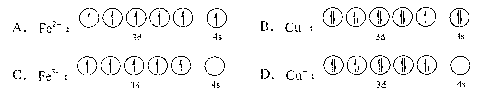
在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
a.x分子的立体构型是,中心原子杂化类型为,属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为,共价键的类型有。
③四方晶系CuFeS2的晶胞结构如图所示。
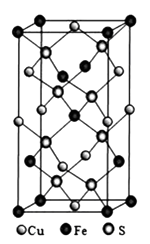
a.Cu+的配位数为,S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。


 B . Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C . 在分子中,两个原子间的键长越长,键能越大
D . 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大
B . Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C . 在分子中,两个原子间的键长越长,键能越大
D . 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大


 B . 硬度由大到小:金刚石
B . 硬度由大到小:金刚石  碳化硅
碳化硅  晶体硅
C . 熔点由高到低:
晶体硅
C . 熔点由高到低:  D . 晶格能由大到小:
D . 晶格能由大到小: 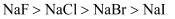
-
(1) 下列Li原子电子排布图表示的状态中,是基态原子电子排布图的是(填标号),能量(由低到高)排在第二位的是(填标号)。
A.
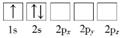
B.

C.

D.
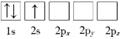
-
(2) Li+与H-具有相同的电子构型,r(H-)r(Li+)(填“<”或“>”),LiAlH4中,不存在(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
-
(3) Li2O是离子晶体,其晶格能可通过图(a)的Bormi﹣Haber循环计算得到。

可知,Li2O晶格能为kJ•mol﹣1 , Li原子的第一电离能为kJ•mol﹣1 , O=O键键能为kJ•mol﹣1。
-
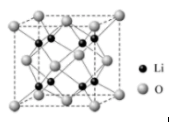
(4) Li2O晶胞如图所示。1个晶胞中有Li+个,O2-个。
 B . 晶格能的大小: Al2O3>MgCl2>NaCl
C . 共价键的键长: F-F>C-Cl>C-S>Si-O
D . 硬度由大到小:金刚石>氮化硅>晶体硅
B . 晶格能的大小: Al2O3>MgCl2>NaCl
C . 共价键的键长: F-F>C-Cl>C-S>Si-O
D . 硬度由大到小:金刚石>氮化硅>晶体硅
-
(1) 基态Zn原子的价电子排布式为,在周期表中位置为。
-
(2) 硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除H外其余元素的第一电离能由大到小排序为。
②在[Zn(NH3)4]SO4溶液中滴加NaOH溶液,未出现浑浊,其原因是。
③已知[Zn(NH3)4]2+的空间构型与SO42-相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为。
④以下作用力在[Zn(NH3)4]SO4晶体中存在的有。
A.离子键 B.极性共价键 C.非极性共价键
D.配位键 E.范德华力 F.金属键
-
(3) ZnS晶胞结构如图(已知a为硫离子,b为锌离子)所示,ZnS晶体的熔点约为1 700 ℃。
①已知晶体密度为ρ g·cm-3 , NA为阿伏加德罗常数的值。则1个ZnS晶胞的体积为cm3。
②ZnO与ZnS结构相似,熔点为1 975 ℃,其熔点较高的原因是。

-
(1) 氯化钠的熔点(804℃)低于氟化钠的熔点(933℃)的主要原因是。
-
(2) CaCl2O是离子化合物,各原子均满足8电子稳定结构,CaCl2O的电子式是。
-
(3) 热胀冷缩是自然界的普遍现象,但当温度由0℃上升至4℃时,水的密度却增大,主要原因是。

-
(1)
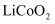 、
、 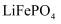 常用作锂离子电池的正极材料。基态钻原子的价电子排布式为;基态磷原子中,电子占据的最高能层符号为。
常用作锂离子电池的正极材料。基态钻原子的价电子排布式为;基态磷原子中,电子占据的最高能层符号为。
-
(2) 锂离子电池的电解液有
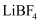 等,碳酸亚乙酯(
等,碳酸亚乙酯( 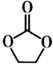 )用作该电解液的添加剂。
)用作该电解液的添加剂。 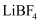 中阴离子的空间构型为;碳酸亚乙酯分子中碳原子的杂化方式为。
中阴离子的空间构型为;碳酸亚乙酯分子中碳原子的杂化方式为。
-
(3) 已知
 的半径为
的半径为 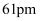 ,
,  的半径为
的半径为  ,由此推断在隔绝空气条件下分别加热
,由此推断在隔绝空气条件下分别加热 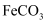 、
、 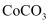 ,其中的分解温度低,原因是。
,其中的分解温度低,原因是。
-
(4)
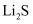 是目前研发的锂离子电池的新型固体电解质,为立方晶系晶体,晶胞参数为
是目前研发的锂离子电池的新型固体电解质,为立方晶系晶体,晶胞参数为 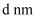 ,晶胞截面图如图所示。
,晶胞截面图如图所示。 
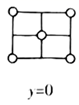

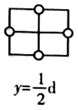
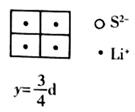
每个晶胞中含有的
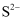 数目为;
数目为;  填充在
填充在 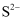 构成的空隙中,每一个空隙由个
构成的空隙中,每一个空隙由个  构成,空隙的空间形状为。
构成,空隙的空间形状为。
-
(1) 钾或钾的化合物焰色反应为紫色。下列对其原理的分析中,正确的是___________(填字母)。A . 电子从基态跃迁到较高的激发态 B . 电子从较高的激发态跃迁到基态 C . 焰色反应的光谱属于吸收光谱 D . 焰色反应的光谱属于发射光谱
-
(2) 镓(Ga)的价层电子排布式为。与Ga元素同周期,且基态原子有2个未成对电子的过渡元素是(填元素符号)。
-
(3)
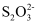 的空间构型为,中心原子S的杂化方式为。[Ag(S2O3)2]3-中不存在的化学键是(填字母序号)
的空间构型为,中心原子S的杂化方式为。[Ag(S2O3)2]3-中不存在的化学键是(填字母序号) A.离子键 B.极性键 C.非极性键 D.配位键
-
(4) 近年来,人们发现了双氢键,双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。下列不可能形成双氢键的是___________。A . Be—H……H—O B . O—H……H—N C . Si—H……H—Al D . B—H……H—N
-
(5) 从结构的角度解释:MgCO3热分解温度低于CaCO3热分解温度的原因是。
-
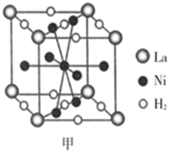
(6) 镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa(镧)的合金可吸附H2的质量为g。
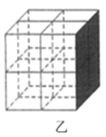
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg处于乙图八个小立方体的体心。若晶体的密度为ρg/cm3 , NA是阿伏加德罗常数,则Mg原子与Ni原子的最短距离为cm。(用含ρ、NA的代数式表示)
| 物质 | Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 熔点 | 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
-
(1) Ni元素位于周期表中区,基态Ni2+外围电子排布图是。
-
(2) Ni(CO)4常用作制备高纯镍粉,常温下为液态,易溶于CCl4、苯等有机溶剂。则:
①Ni(CO)4固态时属于晶体(填晶体类型)
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为,请事写出一种与CO互为等电子体的阴离子的化学式。
-
(3) NiSO4常用于电镀工业,丁二酮肟(
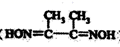 )是检验Ni2+的灵敏试剂,其中碳原子不存在杂化(填“sp”、“sp2”或“sp3”)。
)是检验Ni2+的灵敏试剂,其中碳原子不存在杂化(填“sp”、“sp2”或“sp3”)。
-
(4) NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知晶胞边长为a pm,阿伏加德罗常数为NA , NiO晶体的密度为g/cm3(只列出计算式)。
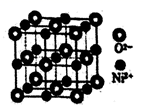
-
(5) NiO、FeO的晶体结构类型均与氯化钠的相同,熔点NiO>FeO,则离子半径r(Ni2+)r(Fe2+)(填“<”或“”>),请简述判断理由。
-
(1) 用法测得硼晶体具有金刚石型结构,其微粒之间存在的作用力是。
-
(2) 一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于晶体,熔点比晶体硼(填“高”或“低”)。
-
(3) N-甲基咪唑的结构为
 , 它的某种衍生物与
, 它的某种衍生物与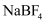 形成的离子化合物
形成的离子化合物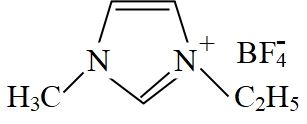 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物
 熔点低的原因是。
熔点低的原因是。②分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。
)。 中存在大π键,其分子中的大π键可表示为。
中存在大π键,其分子中的大π键可表示为。③1mol离子化合物
 中,阿伏加德罗常数的值为
中,阿伏加德罗常数的值为 , 则根据价电子对互斥(
, 则根据价电子对互斥(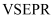 )理论,空间结构为四面体的原子共有个。
)理论,空间结构为四面体的原子共有个。
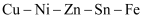 多金属互化物。
多金属互化物。
-
(1) 某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于(填“晶体”或“非晶体”),可通过方法鉴别。
-
(2) 配合物
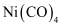 常温下为液态,易溶于
常温下为液态,易溶于 、苯等有机溶剂。固态
、苯等有机溶剂。固态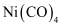 属于晶体;
属于晶体; 和
和 的半径分别为
的半径分别为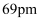 和
和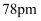 , 则晶体熔点
, 则晶体熔点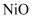
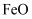 (填“<”或“>”)
(填“<”或“>”)
-
(3) 铜能与类卤素
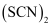 反应生成
反应生成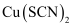 ,
, 
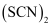 分子含有σ键的数目为;写出一种与
分子含有σ键的数目为;写出一种与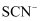 互为等电子体的分子(化学式表示)。
互为等电子体的分子(化学式表示)。
-
(4) 往
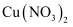 溶液中通入足量
溶液中通入足量 能生成配合物
能生成配合物 。其中
。其中 中心原子的杂化轨道类型为,
中心原子的杂化轨道类型为, 中存在的化学键类型除了极性共价键外,还有。
中存在的化学键类型除了极性共价键外,还有。
-
(5) 立方
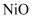 (氧化镍)晶体的结构如图一所示,人工制备的
(氧化镍)晶体的结构如图一所示,人工制备的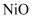 晶体中常存在的缺陷(如图二):一个
晶体中常存在的缺陷(如图二):一个 空缺,另有两个
空缺,另有两个 被两个
被两个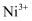 所取代,其结果晶体仍呈电中性,但化合物中
所取代,其结果晶体仍呈电中性,但化合物中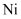 和O的比值却发生了变化。已知某氧化镍样品组成
和O的比值却发生了变化。已知某氧化镍样品组成 , 该晶体中
, 该晶体中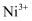 与
与 的离子个数之比为。
的离子个数之比为。
 , 是因为其范德华力更大
B .
, 是因为其范德华力更大
B .  的热稳定性大于
的热稳定性大于 , 是因为键能O-H比S-H大
C . NaCl熔点大于KCl,是因为晶格能NaCl比KCl大
D .
, 是因为键能O-H比S-H大
C . NaCl熔点大于KCl,是因为晶格能NaCl比KCl大
D . 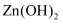 溶于氨水,是因为Zn2+能和
溶于氨水,是因为Zn2+能和 形成稳定的
形成稳定的



