用晶格能的大小衡量离子晶体中离子键的强弱 知识点
用晶格能的大小衡量离子晶体中离子键的强弱 知识点题库
-
(1) 基态氮原子价层电子排布图为,其中电子能量最高的能级是。
-
(2) HOCH2CH2NH2所含非金属元素电负性由大到小顺序为,其中C和N的杂化方式均为HOCH2CH2NH2中∠HOC小于∠HNC,其原因是。
-
(3) HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中区,该环状配离子的配位原子为。
-
(4) 氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的(选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加德罗常数的值为NA , 则该晶体的密度为g•cm-3(列出计算式即可)。

-
(1) 基态Zn原子的价电子排布式为,在周期表中位置为。
-
(2) 硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除H外其余元素的第一电离能由大到小排序为。
②在[Zn(NH3)4]SO4溶液中滴加NaOH溶液,未出现浑浊,其原因是。
③已知[Zn(NH3)4]2+的空间构型与SO42-相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为。
④以下作用力在[Zn(NH3)4]SO4晶体中存在的有。
A.离子键 B.极性共价键 C.非极性共价键
D.配位键 E.范德华力 F.金属键
-
(3) ZnS晶胞结构如图(已知a为硫离子,b为锌离子)所示,ZnS晶体的熔点约为1 700 ℃。
①已知晶体密度为ρ g·cm-3 , NA为阿伏加德罗常数的值。则1个ZnS晶胞的体积为cm3。
②ZnO与ZnS结构相似,熔点为1 975 ℃,其熔点较高的原因是。

|
A组 |
B组 |
C组 |
D组 |
|
金刚石:3550 ℃ |
Li:181 ℃ |
HF:-83 ℃ |
NaCl:801 ℃ |
|
硅晶体:1410 ℃ |
Na:98 ℃ |
HCl:-115 ℃ |
KCl:776 ℃ |
|
硼晶体:2300 ℃ |
K:64 ℃ |
HBr:-89 ℃ |
RbCl:718 ℃ |
|
二氧化硅:1723 ℃ |
Rb:39 ℃ |
HI:-51 ℃ |
CsCl:645 ℃ |
据此回答下列问题:
-
(1) A组属于晶体。
-
(2) B组晶体共同的物理性质是(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
-
(3) C组中HF熔点反常是由于。
-
(4) D组晶体可能具有的性质是(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
-
(5) D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为。
①含有离子的晶体一定是离子晶体 ②分子晶体若采取密堆积方式,其配位数是12 ③含有共价键的晶体一定是原子晶体 ④分子晶体的熔点一定比金属晶体的低 ⑤MgO远比NaCl的晶格能大 ⑥共价键的强弱决定分子晶体熔、沸点的高低
-
(1) 基态
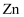 原子的核外电子排布式为。
原子的核外电子排布式为。
-
(2) 一种香豆素衍生物(
 )可作为测定
)可作为测定 的荧光探针,其原理如下图所示。已知
的荧光探针,其原理如下图所示。已知 中
中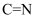 结构的异构化和旋转会导致荧光减弱。
结构的异构化和旋转会导致荧光减弱。

①
 所含元素(C、H、O、N)电负性从大到小的顺序为;
所含元素(C、H、O、N)电负性从大到小的顺序为;②
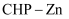 中N原子的杂化类型为;
中N原子的杂化类型为;③加入
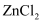 后,体系荧光增强的原因是。
后,体系荧光增强的原因是。 -
(3)
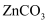 可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。
可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。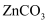 中阴离子
中阴离子 的空间构型为,与
的空间构型为,与 互为等电子体的分子有(任写一种)。
互为等电子体的分子有(任写一种)。
-
(4)
 水溶液可作为工业零件淬火的冷却介质。已知
水溶液可作为工业零件淬火的冷却介质。已知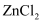 的熔点为275℃,而
的熔点为275℃,而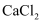 的熔点为782℃,两者熔点相差较大,其原因是。
的熔点为782℃,两者熔点相差较大,其原因是。
-
(5)
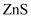 是一种性能优异的荧光材料,在自然界中有立方
是一种性能优异的荧光材料,在自然界中有立方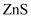 和六方
和六方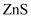 两种晶型,其晶胞结构如下图所示:
两种晶型,其晶胞结构如下图所示:
①立方
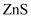 中,
中, 填充在
填充在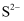 形成的空隙中;
形成的空隙中;②六方
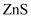 的晶体密度为
的晶体密度为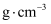 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、
、 、
、 、
、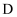 、
、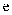 为短周期主族元素,
为短周期主族元素,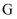 、
、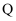 为第四周期元素,它们的原子序数依次增大。
为第四周期元素,它们的原子序数依次增大。 元素原子核外电子数和电子层数相同;
元素原子核外电子数和电子层数相同; 的价电子层中未成对电子有
的价电子层中未成对电子有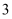 个;
个;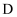 元素为最活泼非金属元素;
元素为最活泼非金属元素;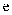 的最高价氧化物对应的水化物既能与酸又能与强碱反应;
的最高价氧化物对应的水化物既能与酸又能与强碱反应;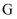 元素正三价离子的
元素正三价离子的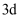 轨道上填充了
轨道上填充了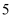 个电子;
个电子;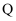 元素基态原子的
元素基态原子的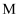 层全充满,
层全充满, 层只有
层只有 个电子。
个电子。
-
(1)
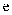 元素在元素周期表中的位置是,
元素在元素周期表中的位置是,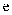 元素基态原子中填有电子的能量最高的能级符号是。
元素基态原子中填有电子的能量最高的能级符号是。
-
(2)
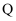 元素基态原子的价电子排布式为,
元素基态原子的价电子排布式为, 为离子化合物,写出其阴离子的电子式(用化学符号表示)。
为离子化合物,写出其阴离子的电子式(用化学符号表示)。
-
(3)
 元素的第一电高能
元素的第一电高能 元素的第一电离能(填“
元素的第一电离能(填“ ”“
”“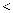 ”或“
”或“ ”),
”), 、
、 、
、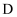 三种元素的电负性由大到小的顺序是(用化学符号表示),
三种元素的电负性由大到小的顺序是(用化学符号表示), 、
、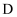 、
、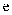 元素形成的简单离子中半径最大的是(用化学符号表示)。
元素形成的简单离子中半径最大的是(用化学符号表示)。
-
(4)
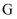 元素正三价离子比正二价离子稳定的原因是。
元素正三价离子比正二价离子稳定的原因是。
-
(5) 向盛有
 的硫酸盐溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解并得到深蓝色的透明液体;若向试管中加入一定量乙醇,析出深蓝色晶体。蓝色沉淀溶解时发生反应的离子方程式是,深蓝色晶体中不存在的化学键有(填字母序号)。
的硫酸盐溶液的试管中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解并得到深蓝色的透明液体;若向试管中加入一定量乙醇,析出深蓝色晶体。蓝色沉淀溶解时发生反应的离子方程式是,深蓝色晶体中不存在的化学键有(填字母序号)。a.离子键 b.极性健 c.非极性键 d.配位键
-
(1) 已知Sn和Si同族,基态Sn原子价层电子的空间运动状态有种,基态氧原子的价层电子排布式不能表示为2s22p
 2p
2p , 因为这违背了(填选项)。
, 因为这违背了(填选项)。A.泡利原理 B.洪特规则 C.能量最低原理
-
(2) [B(OH)4]-中硼原子的杂化轨道类型为,[B(OH)4]-的空间构型为。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是(填选项)。
A.π键 B.σ键 C.配位键 D.极性键
-
(3) 碳酸钡、碳酸镁分解温度较低的是,分解得到的金属氧化物中,熔点较低的是BaO,其原因是。
-
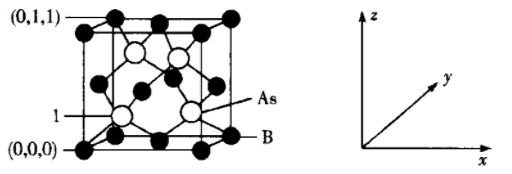
(4) 超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为。已知阿伏加德罗常数的值为NA , 若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为g·cm-3(列出含a、NA的计算式即可)。
-
(1) 硫原子的价电子轨道表示式为。
-
(2) 硫化钠的熔点 (填“大于”“小于”或“等于”)硫化钾的熔点,原因是。
-
(3) 硫酸根和硫代硫酸根的结构如下图所示:
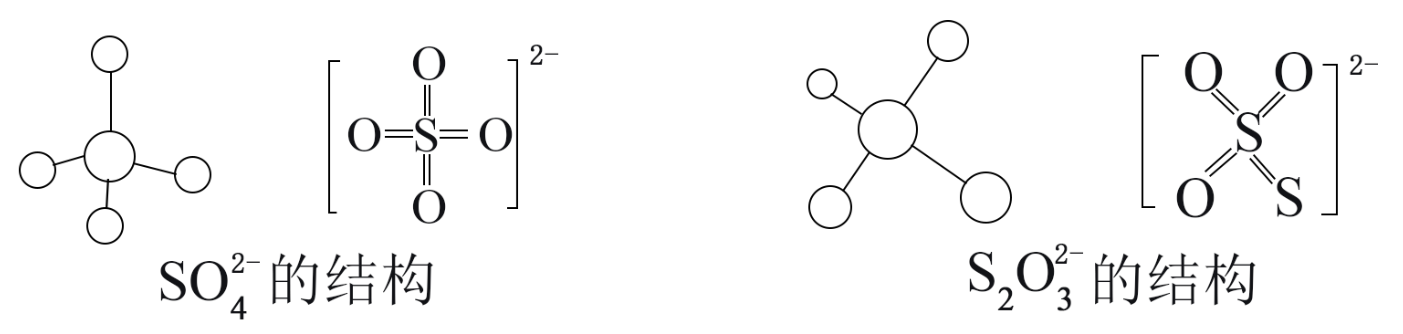
S2O
 的空间构型为, 中心硫原子的杂化轨道类型为。
的空间构型为, 中心硫原子的杂化轨道类型为。 -
(4) 硫原子和氧原子可形成多种链式硫酸根离子,连二硫酸根离子、连三硫酸根离子如下图所示:

这类硫原子数可变的多硫氧合阴离子的化学式可用通式表示为(用n代表硫原子数)。
-
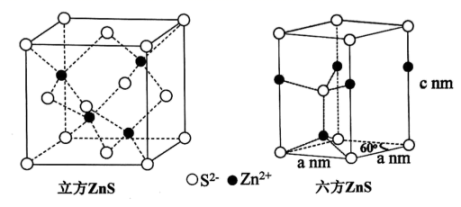
(5) 天然硫化锌以闪锌矿和纤锌矿存在,ZnS的晶体结构如下图所示,闪锌矿中Zn2+的配位数为,已知原子A、B的分数坐标为(0, 0, 0)和(1, 1, 1),原子C的分数坐标为。 纤锌矿晶体堆积模型为。
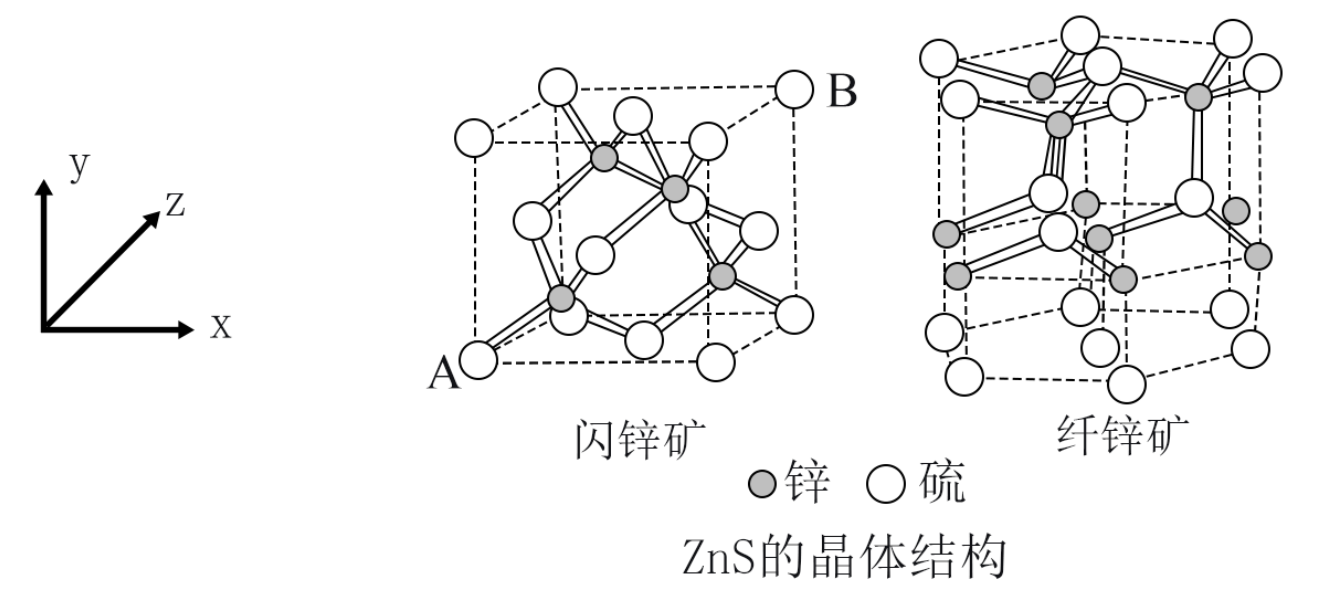
-
(6) 闪锌矿中,设晶胞边长为a, Zn2+和 S2-的离子半径分别为
 和
和 , 则Zn2+和S2-离子的空间占有率为% (列出计算表达式)。
, 则Zn2+和S2-离子的空间占有率为% (列出计算表达式)。
 的沸点低于
的沸点低于 , 是由于C=O键的键能比C=S键的大
D . 因金属性:K>Na>Mg,所以熔点:
, 是由于C=O键的键能比C=S键的大
D . 因金属性:K>Na>Mg,所以熔点:



