晶体的定义 知识点
晶体的定义: 晶体是原子、离子或分子按照一定的周期性,在三维空间作有规律的周期性重复排列所形成的物质。晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体。气体、液体和非晶物质在一定的合适条件下也可以转变成晶体。
晶体的定义 知识点题库
区别晶体与非晶体的最科学的方法是( )
A . 观察各向异性
B . X射线衔射实验
C . 测定固定熔点
D . 观察自范性
从我们熟悉的食盐、金属、冰到贵重的钻石等都是晶体,而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A . 是否具有规则的几何外形
B . 是否具有固定组成
C . 是否具有美观对称的外形
D . 内部基本构成微粒是否按一定规律做周期性重复排列
关于晶体的自范性,下列叙述正确的是( )
A . 破损的晶体能够在固态时自动变成规则的多面体
B . 缺角的氯化钠晶体在饱和的NaCl溶液中慢慢变为完美的立方块
C . 圆形容器中结出的冰是圆形的
D . 由玻璃制成的圆形玻璃球
关于晶体的叙述中,正确的是( )
A . 原子晶体中,共价键的键能越大,熔、沸点越高
B . 分子晶体中,分子间的作用力越大,该分子越稳定
C . 分子晶体中,共价键的键能越大,熔、沸点越高
D . 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
下列关于晶体的性质叙述中,错误的是( )
A . 晶体的自范性指的是在适宜条件下晶体能够自发地呈现规则的多面体几何外形
B . 晶体的各向异性和对称性是矛盾的
C . 晶体的对称性是微观粒子按一定规律做周期性重复排列的必然结果
D . 晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
区分晶体和非晶体最可靠的科学方法是:( )
A . 观察外观是否规则
B . 测定是否有固定的熔点
C . 进行X射线衍射实验
D . 验证是否有各向异性
下列各组物质的晶体中,化学键类型相同,晶体类型不同的是( )
A . NaCl、HCl
B . CO2、SiO2 .
C . SO2、H2O
D . NH4Cl 、CCl4
下列关于晶体的说法中,错误的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定
⑦CsCl和NaCl晶体中阴、阳离子的配位数都为6
A . ①②③
B . ②③④
C . ④⑤⑥
D . ②③⑦
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A . K和Ar
B . C60和晶体硅
C . CO2和SiO2
D . NaCl和CaO
三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。
回答下列问题:
-
(1) 基态Ge原子价电子排布图为,Ge原子的电子发生跃迁时会吸收或发出不同的光,可用光谱分析仪获得光谱(填“连续”或 “线状”),鉴定Ge元素的存在。
-
(2) 锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:Na2GeO3;二锗酸钠:Na2Ge2O5等),也能形成类似于烷烃的锗烷(GenH2n+2)。
①Na2GeO3中锗原子的杂化方式是。
②推测 1molGenH2n+2中含有的σ键的数目是(用NA表示阿伏加德罗常数值)。
-
(3) 利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,其熔点只有7℃其中 EMIM+结构如图所示。
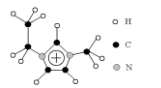
①该物质的晶体类型是。
②EMIM+ 离子中组成元素的电负性由小到大的顺序是。
-
(4) 独立的NH3分子中H-N-H 的键角为 107.3°,[Zn(NH3)6]2+离子中H-N-H的键角107.3° ( 填“大于”、“小于”或“等于” )。
-
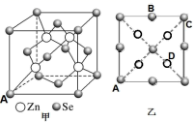
(5) 硒化锌( ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是;已知晶胞边长为a pm,乙图为甲图的俯视图,A点坐标为( 0,0,0),B点坐标为(
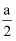 ,a,
,a, 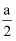 ) ,则 D点坐标为;若该晶胞密度为ρ g·cm-3 , 则阿伏加德罗常数NA为(列出计算式)。
) ,则 D点坐标为;若该晶胞密度为ρ g·cm-3 , 则阿伏加德罗常数NA为(列出计算式)。
已知  熔融状态下能导电。关于
熔融状态下能导电。关于  晶体的分析错误的是( )
晶体的分析错误的是( )
 熔融状态下能导电。关于
熔融状态下能导电。关于  晶体的分析错误的是( )
晶体的分析错误的是( )
A . 是强电解质
B . 存在两种化学键
C . 是离子晶体
D . 阴阳离子个数比为20∶1
下列叙述错误的是( )
A . 超分子是由两个或两个以上分子通过非共价键形成的分子聚集体
B . 金属晶体中含有离子,但不存在离子键
C . 晶体的重要特征是在不同的方向上表现出相同的物理性质
D . 晶体结构中基本的重复单元称为晶胞,晶胞的形状为平行六面体
下列说法错误的是( )
A . 酸性氧化物与碱反应不一定生成盐和水
B . 化学模拟酶催化技术对环境保护、节能减排有重大意义
C . 研究胶体的丁达尔效应、布朗运动推动了原子结构理论的发展
D . 天然晶体的规则的几何外形是其构成微粒有规则排列的结果
1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴及其合金在电机、机械、化工、航空和航天等领域得到广泛的应用,并成为一种重要的战略金属。
回答下列问题:
-
(1) Co(CO3)0.5(OH)·0.11H2O中CO
 中C的价层电子对数为;该化合物中不含有的化学键有(填标号)。
中C的价层电子对数为;该化合物中不含有的化学键有(填标号)。 A.离子键 B.共价键 C.金属键 D.配位键 E。非极性键
-
(2) 纳米结构的氧化钴可在室温下将甲醛(HCHO)完全催化氧化。已知甲醛各原子均满足稳定结构,甲醛分子属于(填“极性”或“非极性”)分子,其立体构型为。橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂,该晶体属于晶体。
-
(3) Co3O4晶体结构中,O2-为立方紧密堆积;Co2+填充于四面体空隙;Co3+为六配位,填充于八面体空隙。Co3+的价层电子排布式为。
-
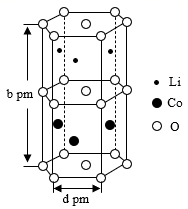
(4) 锂电池的某种电极材料的晶胞结构如图所示。则该晶体的化学式为。已知NA为阿伏加德罗常数的值,则该晶胞的密度为(用含d、b、NA的代数式表示)g·cm-3。
下列关于晶体的说法正确的是( )
A . 能导电的固体一定是金属晶体
B . 判断某固体是否是晶体的直接方法是X-射线衍射实验
C . 分子晶体中分子间作用力越强,分子越稳定
D . 石墨晶体中没有大π键
锌及其化合物在生产生活中应用广泛。回答下列问题:
-
(1) 基态
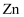 原子的核外电子排布式为。
原子的核外电子排布式为。
-
(2) 一种香豆素衍生物(
 )可作为测定
)可作为测定 的荧光探针,其原理如下图所示。已知
的荧光探针,其原理如下图所示。已知 中
中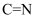 结构的异构化和旋转会导致荧光减弱。
结构的异构化和旋转会导致荧光减弱。

①
 所含元素(C、H、O、N)电负性从大到小的顺序为;
所含元素(C、H、O、N)电负性从大到小的顺序为;②
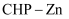 中N原子的杂化类型为;
中N原子的杂化类型为;③加入
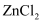 后,体系荧光增强的原因是。
后,体系荧光增强的原因是。 -
(3)
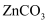 可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。
可用于配制炉甘石洗剂,具有收敛和保护皮肤的作用。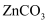 中阴离子
中阴离子 的空间构型为,与
的空间构型为,与 互为等电子体的分子有(任写一种)。
互为等电子体的分子有(任写一种)。
-
(4)
 水溶液可作为工业零件淬火的冷却介质。已知
水溶液可作为工业零件淬火的冷却介质。已知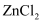 的熔点为275℃,而
的熔点为275℃,而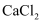 的熔点为782℃,两者熔点相差较大,其原因是。
的熔点为782℃,两者熔点相差较大,其原因是。
-
(5)
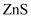 是一种性能优异的荧光材料,在自然界中有立方
是一种性能优异的荧光材料,在自然界中有立方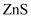 和六方
和六方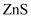 两种晶型,其晶胞结构如下图所示:
两种晶型,其晶胞结构如下图所示:
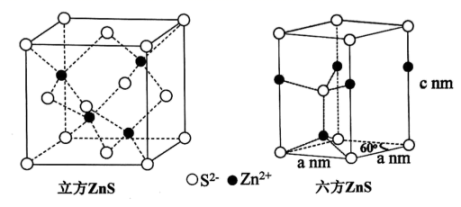
①立方
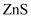 中,
中, 填充在
填充在 形成的空隙中;
形成的空隙中;②六方
 的晶体密度为
的晶体密度为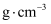 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
某离子化合物的晶胞结构如图所示,晶胞是整个晶体中最基本的重复单元。阴离子位于此晶胞的中心,阳离子位于8个顶点,该离子化合物中,阴、阳离子个数之比是( )
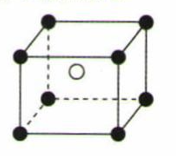
A . 1:8
B . 1:4
C . 1:2
D . 1:1
科学技术在物质结构的研究中具有非常重要的作用。下列说法错误的是( )
A . 质谱仪可以测定分子的相对分子质量
B . 可通过红外光谱分析测得共价键的键长和键角
C . 可通过红外光谱分析物质中含有何种化学键
D . 可通过X射线衍射实验区分晶体和非晶体
下列说法正确的是( )
A .  分子形状呈三角锥形,是非极性分子
B . 凡有规则外形的固体一定是晶体
C . 电负性越大的元素,第一电离能也越大
D .
分子形状呈三角锥形,是非极性分子
B . 凡有规则外形的固体一定是晶体
C . 电负性越大的元素,第一电离能也越大
D .  分子中σ键与π键的数目之比是1:1
分子中σ键与π键的数目之比是1:1
 分子形状呈三角锥形,是非极性分子
B . 凡有规则外形的固体一定是晶体
C . 电负性越大的元素,第一电离能也越大
D .
分子形状呈三角锥形,是非极性分子
B . 凡有规则外形的固体一定是晶体
C . 电负性越大的元素,第一电离能也越大
D .  分子中σ键与π键的数目之比是1:1
分子中σ键与π键的数目之比是1:1
铜的某种氧化物的晶胞结构如图所示。下列说法错误的是( )
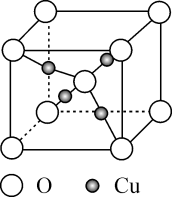
A .  位于元素周期表
位于元素周期表 区
B . 该晶胞中
区
B . 该晶胞中 的配位数为4
C . 该物质的化学式为
的配位数为4
C . 该物质的化学式为 D . O位于
D . O位于 围成的四面体的体心
围成的四面体的体心
 位于元素周期表
位于元素周期表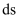 区
B . 该晶胞中
区
B . 该晶胞中 的配位数为4
C . 该物质的化学式为
的配位数为4
C . 该物质的化学式为 D . O位于
D . O位于 围成的四面体的体心
围成的四面体的体心
最近更新



