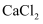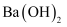原子晶体(共价晶体) 知识点
原子晶体: 是指相邻原子间以共价键相结合形成的具有空间立体网状结构的晶体,整块晶体是一个三维的共价键网状结构,它是一个“巨分子”,又称共价晶体。原子晶体一般具有熔、沸点高,硬度大,不导电,难溶于常见的溶剂等性质。由于共价键具有方向性和饱和性,所以每个中心原子周围排列的原子数目是有限的;所有原子间均以共价键相结合,所以晶体中不存在单个分子。
原子晶体(共价晶体) 知识点题库
目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60(富勒烯)溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中正确的是( )
A . 是两种单质的混合物
B . 晶体属于原子晶体
C . 相对分子质量为2400
D . 分子中不含极性键
现有九种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化钠;⑥二氧化硅晶体;⑦溴化铵;⑧氖;⑨金属铜 请用编号填写下列空白:
-
(1) 通过非极性键形成原子晶体的是 ;熔点最高的晶体是 ;属于分子晶体,且分子为直线型的是 ;由单原子分子构成的分子晶体的是 ;含有非极性键的离子化合物的是 ;能导电且为金属晶体的是
-
(2) 有下列分子:①CCl4②NO2③SO3④BF3⑤NH3其中属于非极性分子的是 ,分子的VSEPR模型为平面三角形的是 ,属于分子的立体构型为三角锥形的是
-
(3) 在相同条件下,SO2在水中的溶解度和CO2在水中的溶解度相比,SO2的溶解度大,请从分子性质的角度阐述理由
-
(4) 有下列四种无机含氧酸:①H3PO4 ②HClO ③H3BO3 ④HNO2根据无机含氧酸的酸性规律,将四种无机含氧酸按酸性相近两两组成一组,它们是
现有几组物质的熔点数据如下表:
A组 | B组 | C组 | D组 |
金刚石:3110℃ | Li:181℃ | HF:﹣83℃ | NaCl:801℃ |
硅晶体:1410℃ | Na:98℃ | HCl:﹣114℃ | KCl:776℃ |
硼晶体:2300℃ | K:64℃ | HBr:﹣89℃ | RbCl:718℃ |
二氧化硅:1723℃ | Rb:39℃ | HI:﹣51℃ | CsCl:645℃ |
据此回答下列问题:
-
(1) A组属于 晶体,其熔化时克服的微粒间的作用力是
-
(2) B组晶体共同的物理性质是 (填序号);①有金属光泽 ②导电性 ③导热性 ④延展性
-
(3) C组中HF熔点反常是由于
-
(4) D组晶体可能具有的性质是 (填序号);①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
有关晶体结构的叙述中,错误的是( )
A . 金刚石的网状结构中,最小的环上有6个碳原子
B . 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键
C . 在金属铜的晶体中,由于存在自由电子,因此铜能导电
D . 在氯化铯晶体中,每个氯离子周围最近且等距离的氯离子有8个
在下列有关晶体的叙述中错误的是( )
A . 稀有气体的原子能形成分子晶体
B . 离子晶体中,一定存在离子键
C . 原子晶体中,只存在共价键
D . 金属晶体的熔沸点均很高
下列有关晶体的叙述中,不正确的是( )
A . 金刚石的网状结构中,由共价键形成的碳原子环,其中最小的环上有6个碳原子
B . 30克SiO2晶体中含有2molSi﹣O键
C . 干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键
D . 石墨中,C原子与C﹣C键数目之比为2:3
根据所学知识回答:
-
(1) 氯酸钾熔化,粒子间克服了 ;二氧化硅熔化,粒子间克服了;碘的升华,粒子间克服了。三种晶体的熔点由高到低的顺序是。
-
(2) 下列六种晶体①CO2 ②NaCl ③Na
④Si ⑤CS2 ⑥金刚石,它们的熔点按从低到高的顺序为(填序号)。
-
(3) 在H2、(NH4)2SO4、SiC、CO2、HF中,能形成分子晶体的物质是(填化学式),含有氢键的晶体的化学式是,属于离子晶体的是,属于原子晶体的是,五种物质的熔点由高到低的顺序是。
下列晶体中①SiO2 ②CO2 ③P4 ④晶体硅 ⑤H2SO4 ⑥P2O5 ⑦SO3 ⑧SiC ⑨冰醋酸
⑩金刚石,属于原子晶体的一组是( )
A . ①③④⑤⑥⑩
B . ①④⑧⑩
C . ③④⑧⑨⑩
D . ①②③④⑤⑥⑦⑧⑨⑩
下列各项所述的数字是6的是( )
A . 在NaCl晶体中,与一个Na+最近的且距离相等的Na+ 的个数
B . 在晶体硅中,围成最小环的原子数
C . 在二氧化硅晶体中,围成最小环的原子数
D . 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数
下列说法不正确的是( )
A . Mg2+和S2-的最外电子层都形成了8个电子的稳定结构
B . 石英和金刚石都是原子间通过共价键结合形成的原子晶体
C . 浓硫酸和H2O混合时放出热量与微粒之间的作用力有关
D . H2O2易分解是因为H2O2分子间作用力弱
-
(1) 比较给出H+的能力的相对强弱:H2CO3C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32‾和C6H5O‾结合H+能力的相对强弱。
-
(2) Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式。
-
(3) 常压下,水晶的硬度比晶体硅的硬度大,其主要原因是。
下列判断正确的是( )
A . 第一电离能:N>C>O
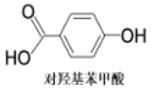
B . 沸点:邻羟基苯甲酸>对羟基苯甲酸(见图) 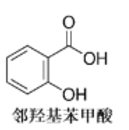
 C . 甲烷分子中H-C-H键角大于氨气分子中H-N-H键角
D . 1 mol金刚石晶体和1 mol SiO2晶体存在的共价键数目相同
C . 甲烷分子中H-C-H键角大于氨气分子中H-N-H键角
D . 1 mol金刚石晶体和1 mol SiO2晶体存在的共价键数目相同

 C . 甲烷分子中H-C-H键角大于氨气分子中H-N-H键角
D . 1 mol金刚石晶体和1 mol SiO2晶体存在的共价键数目相同
C . 甲烷分子中H-C-H键角大于氨气分子中H-N-H键角
D . 1 mol金刚石晶体和1 mol SiO2晶体存在的共价键数目相同
碳元素的单质有多种形式,如图依次是金刚石、石墨和C60的结构示意图:
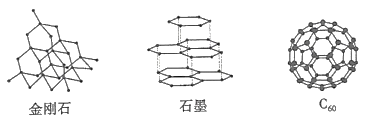
分析上图可知:
-
(1) 金刚石的晶体类型是,晶体中每个最小环上的碳原子的个数是。
-
(2) 石墨晶体呈层状结构,层内每个正六边形拥有的碳原子的个数是,层与层之间的作用力是。
-
(3) C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则Co分子中σ键与π键数目之比为。
石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,具有重要的应用前景。可利用碳化硅制备高品质石墨烯材料。下列说法正确的是( )
A . 24 g石墨烯约含1 mol六元碳环
B . 碳化硅晶胞与金刚石晶胞结构相似
C . 石墨烯的熔点低于碳化硅
D . 利用碳化硅制备石墨烯的过程属于物理剥离
下列晶体的分类正确的一组是( )
|
选项 |
离子晶体 |
共价晶体 |
分子晶体 |
金属晶体 |
|
A |
|
石墨 |
Ar |
Hg |
|
B |
|
金刚石 |
|
Ag |
|
C |
|
SiC |
|
Mg |
|
D |
|
Si |
|
NaH |
A . A
B . B
C . C
D . D
等电子体具有相似的空间结构,下列物质不属于等电子体的是( )
A . SO3和NO  B . B3H6N3和C6H6
C . 金刚石和晶体硅
D . CO2和SiO2
B . B3H6N3和C6H6
C . 金刚石和晶体硅
D . CO2和SiO2
 B . B3H6N3和C6H6
C . 金刚石和晶体硅
D . CO2和SiO2
B . B3H6N3和C6H6
C . 金刚石和晶体硅
D . CO2和SiO2
下列关于晶体的说法中正确的有几个?( )
①离子晶体中一定含有离子键,分子晶体一定含有共价键
②在晶体中只要有阳离子就一定有阴离子
③碘晶体升华时破坏了共价键
④共价晶体中,共价键越强,熔点越高
⑤氯化钠熔化时离子键被破坏
⑥1molSiO2晶体中含有4mol共价键
⑦分子晶体中分子间作用力越大,分子越稳定
⑧Al2O3属于共价晶体
⑨干冰晶体中,每个CO2周围紧邻12个CO2
⑩氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
A . 4
B . 5
C . 6
D . 7
一种碳化硅晶体的晶胞如图所示,与金刚石的类似。下列判断正确的是( )

A . 该晶体质软
B . 熔点:碳化硅>金刚石
C . 该晶体熔融时会破坏极性键
D . 碳原子轨道的杂化类型为sp杂化
干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如图所示。下列说法错误的是( )
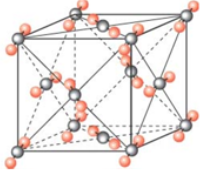
A . 干冰晶体是共价晶体
B . 每个晶胞中含有4个 分子
C . 每个
分子
C . 每个 分子周围有12个紧邻的
分子周围有12个紧邻的 分子
D . 干冰升华时需克服分子间作用力
分子
D . 干冰升华时需克服分子间作用力
 分子
C . 每个
分子
C . 每个 分子周围有12个紧邻的
分子周围有12个紧邻的 分子
D . 干冰升华时需克服分子间作用力
分子
D . 干冰升华时需克服分子间作用力
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A . 磷化硼晶体的化学式为BP,属于离子晶体
B . 磷化硼晶体的熔点高,且熔融状态下能导电
C . 磷化硼晶体中每个原子均形成4条共价键
D . 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
最近更新