等离子体 知识点
等离子体: 等离子体是不同于固体、液体和气体的物质第四态。物质由分子构成,分子由原子构成,原子由带正电的原子核和围绕它的、带负电的电子构成。当被加热到足够高的温度或其他原因,外层电子摆脱原子核的束缚成为自由电子。电子离开原子核,这个过程就叫做“电离”。这时,物质就变成了由带正电的原子核和带负电的电子组成的、一团均匀的“浆糊”,因此人们戏称它为离子浆,这些离子浆中正负电荷总量相等,因此它是近似电中性的,所以就叫等离子体。
等离子体 知识点题库
在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的 DF—31 A 洲际战略
导弹是我国大国地位 、国防实力的显著标志。其制作材料中包含了 Fe 、Cr 、Ni 、C 等多种元素。回答下列问题:
-
(1) 基态镍原子的价电子排布式为 。
-
(2) 与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的区。
-
(3) 铁元素能与CO形成 Fe (CO)5。羰基铁[ Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含mol σ键,与CO互为等电子体的一种离子的化学式为。
-
(4) 碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的 空隙和 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(
 ,0,
,0,  ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为。 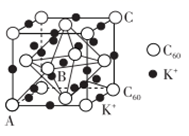
-
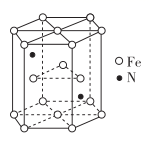
(5) 某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加德罗常数的值为NA , 则该磁性氮化铁的晶体密度为_g/cm3( 列出计算式)。
化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
-
(1) 钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O
 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+ ①基态S原子核外有种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:
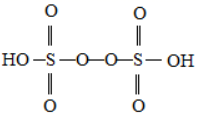
H2S2O8中硫原子的轨道杂化方式为;上述反应每生成1molMnO4— , S2O82—断裂的共价键类型及其数目分别为、(设阿伏加德罗常数的值为NA)
-
(2) Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:、一种离子:。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:,1molH2NCONH2(尿素)分子中含有σ键的数目为。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。
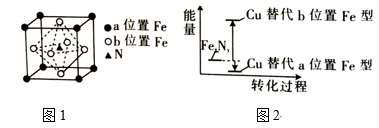
Cu处于周期表中区,其最高能层的符号为,基态铜原子的价电子排布式为。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为。
-
(3) 铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为。
下列说法中正确的是( )
A . 在二氧化硅晶体中 ,最小的环上的原子个数为 6
B . HCl分子里含有一个s-p σ键
C . 3p3 表示 3p 能级有三个轨道
D . SO3与  互为等电子体 ,且它们中心原子都是 sp3 杂化
互为等电子体 ,且它们中心原子都是 sp3 杂化
 互为等电子体 ,且它们中心原子都是 sp3 杂化
互为等电子体 ,且它们中心原子都是 sp3 杂化
下列关于物质特殊聚集状态的叙述中,不正确的是( )
A . 在电场存在的情况下,液晶分子沿着电场方向有序排列
B . 非晶体的内部原子或分子的排列杂乱无章
C . 液晶最重要的用途是制造液晶显示器
D . 由纳米粒子构成的纳米陶瓷有极高的硬度,但低温下不具有优良的延展性
下列说法不正确的是( )
A . 纳米颗粒界面通常为无序结构,但内部具有晶状结构
B . 利用红外光谱实验可确定青蒿素分子中含有的部分基团
C . 超分子内部分子之间通过氢键、弱配位键等相结合
D . 电子表液晶显示器在施加电场时,液晶分子沿垂直于电场方向排列
某课题组设计合成的双(β-二酮)钛(Ⅳ)配合具有抗肿瘤作用,合成路线如下:
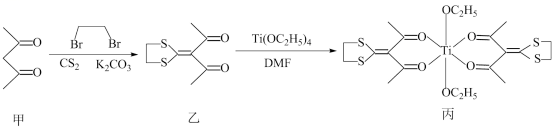
下列说法正确的是( )
A . 乙的分子式为C8H8O2S2
B . K2CO3中阴离子的VSEPR模型为正四面体形
C . 物质甲中含σ键和Π键的数目之比为7:1
D . 丙中Ti的配位数为4
下列说法不正确的是( )
A . 离子液体有难挥发的特点,常被用于有机合成的溶剂
B . 冠醚与碱金属离子通过离子键形成超分子
C . 等离子体是一种特殊的气体,由带电的阳离子、电子及电中性粒子组成
D . 液晶既具有液体的流动性,又具有类似晶体的各向异性
科学研究表明,物质含有许多种聚集状态,下列关于物质聚集状态的描述错误的是( )
A . 等离子体的外观为气态
B . 液晶和液态是物质的两种聚集状态
C . 等离子体的基本构成粒子只有阴、阳离子
D . 离子液体是熔点不高的仅由离子组成的液体物质
钛被誉为“21世纪的金属”,工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C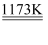 TiCl4+2CO;②TiCl4+2Mg
TiCl4+2CO;②TiCl4+2Mg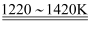 Ti+2MgCl2
Ti+2MgCl2
-
(1) 基态Ti原子的价电子排布图(轨道表示式)为。
-
(2) 写出与CO互为等电子体的两种常见微粒。
-
(3) 已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃。TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①写出TiCl4的化学键类型。
②TiCl4在潮湿空气中水解的化学方程式是。
-
(4) 配离子[TiCl(H2O)5]2+中Ti的化合价为,配体为。
下列关于物质特殊聚集状态结构的叙述中,错误的是( )
A . 等离子体的基本构成微粒是带电的离子和电子及不带电的分子或原子
B . 超分子内部分子之间可以通过非共价键结合
C . 液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性
D . 纳米材料包括纳米颗粒与颗粒间的界面两部分,两部分都是长程有序
下列说法错误的是( )
A . 离子液体有难挥发的特点,常被用于有机合成的溶剂
B . 冠醚与碱金属离子通过离子键形成超分子
C . 等离子体是一种特殊的气体,由带电的阳离子、电子及电中性粒子组成
D . 液晶既具有液体的流动性,又具有类似晶体的各向异性
下列有关物质结构与性质的叙述正确的是( )
A . 等离子体是只由离子组成的具有带电性的气态物质
B . 1molCo3+的八面体配合物[CoClx(NH3)y]Clz与足量AgNO3溶液作用生成2molAgCl沉淀,则x、y、z的值分别为2、4、2
C . 若MgO的化学键中离子键的百分数为50%,则MgO可看作离子晶体与共价晶体之间的过渡晶体
D . 利用超分子的自组装特征,可以分离C60和C70
最近更新



