物质结构中的化学键数目计算 知识点题库
晶体硼的结构如图所示,熔点2573K。已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。下列有关说法错误的是( )

A . 每个结构单元含有12个硼原子
B . 1mol晶体硼中含有30NA个B—B键
C . 晶体硼中键角是60°
D . 晶体硼是分子晶体
设NA为阿伏加德罗常数的值,下列说法错误的是( )
A . 1 mol CH2=CH2分子中含有的共价键数为6NA
B . 500 mL 0.5 mol·L−1的NaCl溶液中微粒数大于0.5NA
C . 30 g HCHO与CH3COOH混合物中含C原子数为NA
D . 2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
COCl2分子的结构式为  ,COCl2分子内含有( )
,COCl2分子内含有( )
 ,COCl2分子内含有( )
,COCl2分子内含有( )
A . 4个σ键
B . 2个σ键,2个π键
C . 2个σ键、1个π键
D . 3个σ键、1个π键
已知 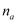 是阿伏加德罗常数的值,下列说法错误的是( )
是阿伏加德罗常数的值,下列说法错误的是( )
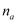 是阿伏加德罗常数的值,下列说法错误的是( )
是阿伏加德罗常数的值,下列说法错误的是( )
A .  含有的中子数为1
含有的中子数为1  B .
B . 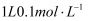 磷酸钠溶液含有的
磷酸钠溶液含有的  数目为0.1
数目为0.1 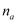 C .
C .  被还原为
被还原为  转移的电子数为6
转移的电子数为6 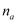 D . 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13
D . 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13 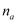
 含有的中子数为1
含有的中子数为1 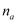 B .
B . 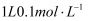 磷酸钠溶液含有的
磷酸钠溶液含有的  数目为0.1
数目为0.1 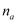 C .
C .  被还原为
被还原为  转移的电子数为6
转移的电子数为6 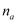 D . 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13
D . 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13 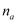
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 12g石墨和C60的混合固体中,含NA个碳原子
B . 标准状况下,2.24L水中含有0.1NA个水分子
C . 7.8g过氧化钠含有的共用电子对数为0.2NA
D . 5.6g铁在足量氯气中燃烧,电子转移数目为0.2NA
设  表示阿伏加德罗常数的值,下列说法错误的是( )
表示阿伏加德罗常数的值,下列说法错误的是( )
 表示阿伏加德罗常数的值,下列说法错误的是( )
表示阿伏加德罗常数的值,下列说法错误的是( )
A . 56g铁在足量氧气中完全燃烧,转移的电子数小于 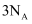 B . 在
B . 在 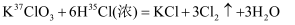 反应中,若有212g氯气生成,则反应中电子转移的数目为
反应中,若有212g氯气生成,则反应中电子转移的数目为 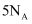 C .
C . 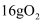 和
和  的混合物中所含中子数为
的混合物中所含中子数为 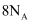 D . 常温下,
D . 常温下, 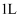
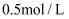
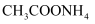 溶液的
溶液的  ,则溶液中
,则溶液中  与
与  的数目均为
的数目均为 
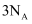 B . 在
B . 在 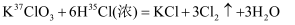 反应中,若有212g氯气生成,则反应中电子转移的数目为
反应中,若有212g氯气生成,则反应中电子转移的数目为 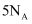 C .
C . 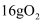 和
和  的混合物中所含中子数为
的混合物中所含中子数为 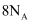 D . 常温下,
D . 常温下, 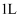
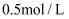
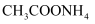 溶液的
溶液的  ,则溶液中
,则溶液中  与
与  的数目均为
的数目均为 
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A . 0.1mol重水(D2O) 分子中含有的中子数为NA
B . 10g质量分数为46%的C2H5OH水溶液中含有的氧原子数目为0.1NA
C . 标准状况下,2.24L己烷中含有的共价键数目为1.9NA
D . 过氧化氢分解制得标准状况下2.24LO2 , 转移电子数目为0.4NA
NA为阿伏加德罗常数,下列叙述中正确的是( )
A . 标准状况下,8.4g己烷中共价键数目为1.8NA
B . 常温下,0.1mol乙烷与乙烯混合气体中所含碳原子数为0.2NA
C . 在标准状况下,2.24 L氯仿中所含分子数为0.1NA
D . 1mol苯分子中含有碳碳双键数为3NA
设NA为阿伏加德罗常数的数值,下列说法错误的是( )
A . 46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
B . 2.3gNa与O2完全反应,转移电子总数为0.1NA
C . 常温下,0.2mol/LNH4Cl溶液中,NH4+数目小于0.2NA
D . 1molSiO2晶体中,含有Si−O键的数目为4 NA
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
①31 g白磷(P4)中含有1.5NA个P—P键
②1 L 0.1 mol·L-1的Na2CO3溶液中所含阴离子的总数为0.1NA
③标准状况下,22.4 L HF中含有NA个分子
④56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定是3 NA
⑤1 mol H2和1 mol I2在加热条件下充分反应,生成HI的分子数为2NA
⑥常温下,含有0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142 g Na2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数为3NA
⑧1molFeCl3溶于水形成的胶体中含有NA个Fe(OH)3胶体粒子
A . ①③④
B . ①⑥⑦
C . ③⑤⑦
D . ①④⑧
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A . 2.8g14N2与14C16O的混合物中,中子数目为 l.4NA
B . 含 0. 1 molFeCl3的溶液与0.1 mol 锌充分反应,转移电子数为0.1 NA
C . 标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D . 某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A . 在密闭容器中,使1molN2和3molH2充分反应后生成NH3的分子数为2NA
B . 标准状况下,0.56 L 丙烷中含有共价键的数目为0.2NA
C . 2g H218O和D2O 的混合物中,含有的中子数为NA
D . 若1mol 氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
NA 为阿伏加德罗常数的值。下列说法正确的是( )
A . 2.24L(标准状况下)甲苯在O2中完全燃烧,得到0.7NA个CO2分子
B . 1mo1乙酸(忽略挥发损失)与足量的C2H518OH浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
C . 14g乙烯和丙烯混合气体中的氢原子数为2NA
D . 常温常压下,78g苯含有σ键数为6NA
肼  是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应:
是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应:  。用
。用  表示阿伏加德罗常数的值,下列说法中正确的是( )
表示阿伏加德罗常数的值,下列说法中正确的是( )
 是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应:
是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应:  。用
。用  表示阿伏加德罗常数的值,下列说法中正确的是( )
表示阿伏加德罗常数的值,下列说法中正确的是( ) 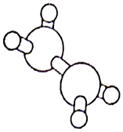
A . 标准状况下, 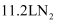 中所含电子总数为
中所含电子总数为 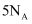 B . 标准状况下,
B . 标准状况下,  中所含原子总数为
中所含原子总数为  C . 标准状况下,
C . 标准状况下,  中含有共价键的总数为
中含有共价键的总数为  D . 若生成
D . 若生成 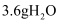 ,则上述反应转移电子的数目为
,则上述反应转移电子的数目为 
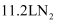 中所含电子总数为
中所含电子总数为 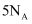 B . 标准状况下,
B . 标准状况下,  中所含原子总数为
中所含原子总数为  C . 标准状况下,
C . 标准状况下,  中含有共价键的总数为
中含有共价键的总数为  D . 若生成
D . 若生成 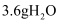 ,则上述反应转移电子的数目为
,则上述反应转移电子的数目为 
下列有关说法错误的是( )
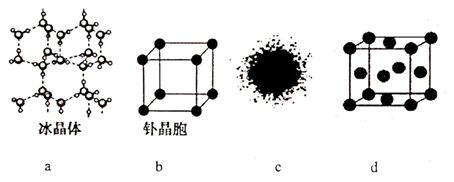
A . 18g的冰晶体中含氢键4mol
B . 钋(Po)是一种放射性金属,采用简单立方堆积,空间利用率为52%
C . H原子的电子云图如图c所示,电子云密度大的区域电子数自多
D . 金属Cu的晶胞结构如图d所示,晶胞中Cu原子的配位数为12
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 2.8g所有的单烯烃含有的C—H个数都为0.4NA
B . 标准状况下,2.24LNO2气体与水完全反应,转移电子总数为0.1NA
C . 0.1mol/L的NaHCO3溶液中,n(HCO  )<0.1mol
D . 3.6gH218O中所含电子数为2NA
)<0.1mol
D . 3.6gH218O中所含电子数为2NA
 )<0.1mol
D . 3.6gH218O中所含电子数为2NA
)<0.1mol
D . 3.6gH218O中所含电子数为2NA
元素周期表中第四周期的某些过渡元素(如V、Zn、Co等)在生产、生活中有着广泛的应用。
-
(1) 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①基态钒原子的外围电子排布式为。
②V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为。
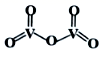
-
(2) Co(NH3)5Cl3是钴的一种配合物,中心离子的配位数为6,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀。
①
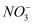 的空间构型为。
的空间构型为。 ②则该配合物中配离子的化学式为。
-
(3) ZnF2是生成良好的光学基质材料KZnF3的原料,ZnF2、KZnF3两种晶体的晶胞结构如图所示:
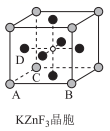
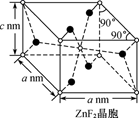
①已知:ZnF2的熔点为872℃,ZnCl2的熔点为275℃,ZnBr2的熔点为394℃,ZnBr2的熔点高于ZnCl2的原因为。
②KZnF3晶体(晶胞顶点为K+)中,与Zn2+最近且等距离的F-数为。
③若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为g/cm3(用含a、c、NA的代数式表示)。
潜艇中氧气来源之一的反应是: 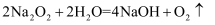 。用
。用  表示阿伏加德罗常数,下列说法正确的是( )
表示阿伏加德罗常数,下列说法正确的是( )
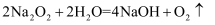 。用
。用  表示阿伏加德罗常数,下列说法正确的是( )
表示阿伏加德罗常数,下列说法正确的是( )
A . 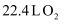 含
含  个O原子
B .
个O原子
B .  含有的质子数为
含有的质子数为  C .
C . 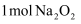 含共价键的总数为
含共价键的总数为  D . 上述反应,每生成
D . 上述反应,每生成 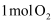 转移
转移  电子
电子
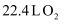 含
含  个O原子
B .
个O原子
B .  含有的质子数为
含有的质子数为  C .
C . 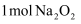 含共价键的总数为
含共价键的总数为  D . 上述反应,每生成
D . 上述反应,每生成 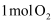 转移
转移  电子
电子
已知NA是阿伏加德罗常数的值,下列说法正确的是:( )
A . 60g乙酸和丙醇混合物中含有的分子数目为2NA
B . 3g 3He含有的中子数为1NA
C . 1mol Fe溶于过量硝酸,电子转移数为2NA
D . 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
N、P、As都是第VA族元素。下列说法正确的是( )
A . 三种元素的氢化物沸点大小顺序为 B . 白磷的分子式为P4 , 为正四面体结构,是由极性键构成的非极性分子
C .
B . 白磷的分子式为P4 , 为正四面体结构,是由极性键构成的非极性分子
C .  中,N原子的杂化轨道类型为sp3和sp2
D . 配合物
中,N原子的杂化轨道类型为sp3和sp2
D . 配合物 中,
中,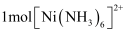 含有的
含有的 键总数为
键总数为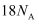
 B . 白磷的分子式为P4 , 为正四面体结构,是由极性键构成的非极性分子
C .
B . 白磷的分子式为P4 , 为正四面体结构,是由极性键构成的非极性分子
C .  中,N原子的杂化轨道类型为sp3和sp2
D . 配合物
中,N原子的杂化轨道类型为sp3和sp2
D . 配合物 中,
中,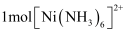 含有的
含有的 键总数为
键总数为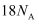
最近更新



