质量守恒定律 知识点题库
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )

A . 1∶1
B . 2∶3
C . 3∶2
D . 2∶1
如图是某反应的微观示意图,下列说法不正确的是( )

A . 反应物中有单质
B . 该反应为置换反应
C . 生成物的分子个数比为1:1
D . 化学反应前后原子的种类不变
某纯净物X在密闭容器中稍加热就分解为NH3、H2O和CO2 , 根据这一实验事实能得出的结论是( )
A . X由四种元素组成
B . X是化合物
C . X中有水
D . X 很稳定
物质在发生化学反应时( )
A . 它们的质量一定相等
B . 它们的物质的量一定相等
C . 它们的质量比等于方程式中化学计量数之比
D . 它们物质的量比等于方程式化学计量数之比
相同条件下,10mlA2气体与30mlB2气体恰好完全反应生成20ml某气体X,则可推出X的化学式
汽油,柴油等燃料都是有机物(含C,H等元素),它们都是由石油中提炼出来的,一些骗子声称,他们发明了一种催化剂,只要在水中加入少量的这种试剂,就可以使普通的水变成燃料油,从而解决世界性的能源问题.请你根据你所学的化学知识,驳斥这种谎言的荒谬之处.
化学中有许多的“守恒相等”,下列不符合的是( )
A . 化学反应中,反应物总能量与生成物总能量
B . 化学反应中,反应物总质量与生成物总质量
C . 溶液中,稀释前溶质质量与稀释后溶质质量
D . 在化合物中,正化合价总数与负化合价总数
取式量为46的某有机物4.6克,在足量的氧气中充分燃烧,生成8.8克二氧化碳和5.4克水,据此判断该有机物( )
A . 只由碳、氢两种元素组成
B . 一定含有碳、氢、氧三种元素
C . 其分子中C,H,O原子个数比为2:6:1
D . 其化学式为CH2O2
某工业废水中大量存在以下浓度的几种离子:0.4mol/LCl-、0.8mol/L SO42-、0.2mol/LAl3+、0.6mol/LH+、R离子,则R离子及其物质的量浓度可能为( )
A . 0.8mol/L Ag+
B . 0.4mol/L Ba2+
C . 0.4mol/LMg2+
D . 0.2mol/L CO32-
已知某两种物质在光照条件下能发生化学反应,其微观示意图如下(一种小球代表一种原子):
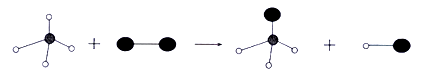
则下列说法正确的是( )
A . 参加反应的物质均为化合物
B . 该反应属于复分解反应
C . 该反应不符合质量守恒定律
D . 图示中共有4种分子
13.6gFe和Fe2O3的混合物,加入150mL足量的稀硫酸,在标准状况下收集到1.12LH2 , 向反应后的溶液中滴加KSCN溶液不变红。为中和过量的H2SO4 , 并使Fe元素全部转化为Fe(OH)2沉淀,恰好消耗了200mL 3mol/L的NaOH溶液,则该稀H2SO4的物质的量浓度为()
A . 2.25mol/L
B . 2mol/L
C . 3mol/L
D . 0.6mol/L
在化学反应中一定发生变化的是( )
A . 各元素的化合价
B . 物质总物质的量
C . 物质的总质量
D . 物质中的化学键
煤中加入石灰石,燃烧时可减少SO2的排放,反应为2CaCO3+X+2SO2=2CaSO4+2CO2(已配平),其中物质X为( )
A . CO
B . O2
C . CS2
D . CaO
乙烯是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,也是一种植物生长调节剂,在生产生活中有重要应用。下列有关乙烯及其工业产品乙醇的性质及应用,请作答。
-
(1) 将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为;
-
(2) 下列各组化学反应中,反应原理相同的是(填序号);
①乙烯使溴的四氯化碳溶液褪色和乙烯使酸性KMnO4溶液褪色
②苯与液溴在催化剂作用下的反应和乙醇使酸性KMnO4溶液褪色
③甲烷光照条件下与氯气反应和苯与硝酸在浓硫酸条件下反应
-
(3) 取等物质的量的乙醇和乙烯,在足量的氧气中完全燃烧,两者耗氧量的关系乙醇乙烯(填大于、小于、等于);
-
(4) 工业上可由乙烯水合法生产乙醇,乙烯水合法可分为两步(H2SO4可以看作HOSO3H)
第一步:反应CH2=CH2+HOSO3H(浓硫酸)→CH3CH2OSO3H (硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
①第一步属于(填反应类型)反应;
②上述整个过程中浓硫酸的作用是(填选项)
A.氧化剂 B.催化剂 C.还原剂
-
(5) 发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇植物秸秆
 C6H12O6
C6H12O6  2CH3CH2OH+2CO2↑现要制取2.3吨乙醇,至少需要植物秸秆吨。
2CH3CH2OH+2CO2↑现要制取2.3吨乙醇,至少需要植物秸秆吨。
由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A . 1.00 mol/L
B . 0.500 mol/L
C . 2.00 mol/L
D . 3.00 mol/L
已知Q与R的摩尔质量之比为9∶22,在反应X+2Y=2Q +R中,当1.6gX与一定量Y完全反应后,生成4.4gR,则参与反应的Y和生成物Q的质量之比为( )
A . 46∶9
B . 32∶9
C . 23∶9
D . 16∶9
已知反应:As2S3+HNO3+X→H3AsO4+H2SO4+ NO↑,下列关于该反应的说法错误的是( )
A . X为H2O
B . 参加反应的HNO3全部被还原
C . 氧化产物为H2SO4和H3AsO4
D . 生成1mol H2AsO4转移2mole-
碱式硫酸铁[化学式Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,可由FeSO4和KClO3在水溶液中反应得到,有关反应的化学方程式如下:6FeSO4+KClO3+_=6Fe(OH)SO4+KCl
-
(1) 请将上述化学方程式补充完整。
-
(2) 用双线桥法标出上述反应中转移电子的方向和数目。
-
(3) 上述反应中的还原剂是,被还原的元素是,每1molFeSO4参加反应,转移电子mol。
玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH  2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
(x-1)S+K2S  K2Sx(x=2~6)
K2Sx(x=2~6)
S+ K2SO3  K2S2O3
K2S2O3
请计算:
-
(1) 0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3 , 则V=。
-
(2) 2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3 , 则x=。(写出计算过程)
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析错误的是( )

A . 混合酸中HNO3的物质的量浓度为2 mol·L-1
B . 原混合酸中H2SO4的物质的量为0.4 mol
C . OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+ , BC段产生氢气
D . 第二份溶液中的最终溶质为FeSO4
最近更新



