溶液中溶质的质量分数及相关计算 知识点题库
某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的质量分数是( )
A . 26.5%
B . 30%
C . 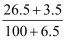 ×100%
D .
×100%
D .  ×100%
×100%
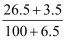 ×100%
D .
×100%
D .  ×100%
×100%
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是 .
(2)水的净化与软化的区别是 .
(3)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 g,后加入Na2CO3 g.
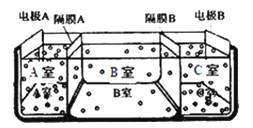
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.
①隔膜A是 离子交换膜(填“阴”或“阳”).
②某种海水样品,经分析含有大量的Na+、Cl﹣ , 以及少量的K+、SO42﹣ . 若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc , 则其大小顺序为 .
有一在空气中暴露的NaOH固体,经分析测知其中含水2.8%,Na2CO37.2%,取3.50g该样品与1mol/L的盐酸100mL充分反应后,再用质量分数为37%的NaOH溶液中和过量的盐酸,将所得的溶液蒸干,所得的固体的质量为( )
A . 2.93g
B . 3.51g
C . 4.00g
D . 5.85g
已知20℃时,饱和NaCl溶液的密度为ρg/cm3 , 物质的量浓度为c mol/L,则下列说法中不正确的是( )
A . 温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B . 此溶液中NaCl的质量分数为 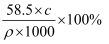 C . 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D . 20℃时,饱和NaCl溶液的溶解度
C . 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D . 20℃时,饱和NaCl溶液的溶解度 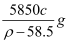
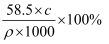 C . 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D . 20℃时,饱和NaCl溶液的溶解度
C . 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D . 20℃时,饱和NaCl溶液的溶解度 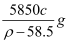
甲、乙两种固体物质的溶解度曲线如图所示.下列说法正确的是( )
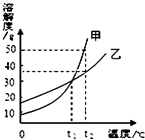
A . 甲的溶解度大于乙的溶解度
B . 升高温度可使甲的不饱和溶液变为饱和溶液
C . t1℃时,甲、乙两种饱和溶液的溶质质量分数相等
D . t2℃时,50g乙加入100g水中得到乙的不饱和溶液
25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )
A . 纯硫酸的摩尔质量为98
B . 上述100mL稀硫酸中含溶质14g
C . 上述稀释过程所需要的蒸馏水为90mL
D . 质量分数为50%的硫酸物质的量浓度为7.14mol/L
已知某饱和 NaCl 溶液的体积为V mL.密度为ρ g/cm3 , 质量分数为 w%.物质的量浓度为c mol/L,溶液中含NaCl的质量为m g.
-
(1) 用m、V表示溶液物质的量浓度.
-
(2) 用w、ρ表示溶液物质的量浓度.
-
(3) 用c、ρ表示溶液的质量分数.
-
(4) 用w表示该温度下NaCl的溶解度.
制备1 L含氨10%的氨水(密度是0.96 g mL -1 ),需要标准状况下的氨气多少升?
常温下,将20.0 g质量分数为14.0%的KNO3溶液跟30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g·cm−3的混合溶液。计算:
-
(1) 混合后溶液的质量分数是多少?
-
(2) 混合后溶液的物质的量浓度是多少?
-
(3) 在1000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
现有密度为dg/mL浓度为18mol/L的浓硫酸溶液100g ,需要加入一定量的水将其稀释为浓度是9mol/L,则加入水的体积是( )
A . 大于100mL
B . 小于 l00mL
C . 等于 100mL
D . 等于 100/d mL
已知氨水的密度比水小,现有质量分数分别为10%利50%的两种氨水,将其等体积混合,则所得混合溶液溶质质量分数是()
A . >30%
B . =30%
C . <30%
D . 无法确定
将 100g 浓度为 18mol/L、密度为ρg / ml 的 浓 硫 酸 加 入一定量的水(密度为 1g / cm3 )中稀释成 9 mo l/ L 的 硫 酸 , 则 加入水的体积 ( )
A . 大于 100ml
B . 等于 100ml
C . 小于 100ml
D . 等于100ml
欲使100g5%的硝酸钠溶液浓度增大到20%,需再加入硝酸钠固体( )
A . 18.75g
B . 19.75g
C . 20g
D . 25g
标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为;若所得溶液密度为1.1 g·cm-3 , 则溶液中含HCl的质量分数为;从该溶液中取出10 mL浓盐酸溶解于水中配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有;配制过程中,造成浓度偏低的操作可能有(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯和玻璃棒,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线
E.定容时,俯视液面加水至刻度线
从海水中可提取多种化工原料,下面是工业上对海水资源综合利用的示意图。试回答下列问题:
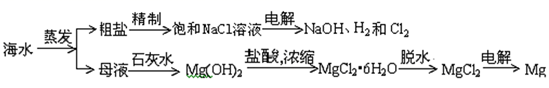
-
(1) 粗盐中含有Ca2+、Mg2+、
 等杂质离子,精制时所用试剂为A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。则加入试剂的顺序是(填序号)。
等杂质离子,精制时所用试剂为A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。则加入试剂的顺序是(填序号)。
-
(2) 写出电解饱和氯化钠溶液的化学方程式:。
-
(3) 电解无水MgCl2可制取镁和Cl2,化学方程式为。
-
(4) 工业上是将氯气通入到30%的NaOH溶液中来制取NaClO溶液(84消毒液),若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为kg(保留整数)。
下列叙述错误的是( )
A . 10mL质量分数为98%的H2SO4,用10mL水稀释后H2SO4的质量分数大于49%
B . 配制0.1 mol•L﹣1的Na2CO3溶液480mL,需用500mL容量瓶
C . 用浓硫酸配制一定物质的量浓度的稀硫酸时,量取浓硫酸时仰视量筒,会使所配溶液浓度偏小
D . 同温同压下20mL CH4和60 mLO2所含的原子数之比为5:6
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1 , 质量分数为w , 其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A . 溶质的质量分数w=a/(ρV-a)×100%
B . 溶质的物质的量浓度c=1000a/35V mol·L-1
C . 溶液中c(OH-)=1000b/V mol·L-1+c(H+)
D . 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数。现取10 g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液的pH变化如右图所示。试回答:

-
(1) a点溶液中含有的溶质有。
-
(2) 当pH=7时,消耗NaOH溶液中溶质的质量为g。
-
(3) 计算稀硫酸溶液中溶质的质量分数。(要求写出必要的计算过程)
体积为VmL,密度为ρg∙mL−1的溶液中,含有摩尔质量为M g∙mol−1的溶质mg,其物质的量浓度为c mol∙L−1 , 溶质的质量分数为a%。下列关系式错误的是( )
A . a%=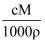 ×100%
B . c=
×100%
B . c=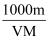 (mol∙L−1)
C . c=1000ρ∙aM(mol∙L−1)
D . m=V×ρ×a%
(mol∙L−1)
C . c=1000ρ∙aM(mol∙L−1)
D . m=V×ρ×a%
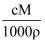 ×100%
B . c=
×100%
B . c=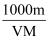 (mol∙L−1)
C . c=1000ρ∙aM(mol∙L−1)
D . m=V×ρ×a%
(mol∙L−1)
C . c=1000ρ∙aM(mol∙L−1)
D . m=V×ρ×a%
将4.6g金属钠与95.6g水中,得到的溶液中溶质的质量分数是( )
A . 稍小于4.6%
B . 4.6%
C . 8.0%
D . 稍小于8.0%
最近更新



