阿伏加德罗定律及推论 知识点题库
一个集气瓶的质量为20.0g,在相同状况下,装满O2时质量为21.0g,装满A气体时为22.0g,则A气体的摩尔质量为( )
A . 16g/mol
B . 32g/mol
C . 64g/mol
D . 128g/mol
下列叙述正确的是( )
A . 为了节约,应将所有实验过程中取用的剩余药品放回原试剂瓶
B . 同温同压下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物的化学式为 XY3
C . 将25g胆矾晶体溶于1000mL水中,所得溶液中CuSO4的物质的量浓度为0.1mol/L
D . 还原剂失去电子越多,还原性越强,氧化剂得到电子越多,氧化性越强
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A . 两种气体的压强相等
B . O2比O3质量小
C . 两种气体的分子数目相等
D . 两种气体的氧原子数目相等
某双原子分子构成的气体,该气体分子的相对分子质量为M,现在收集到该气体m g,设阿伏加德罗常数为NA , 请用代数式表示出下列数据
-
(1) 该气体的摩尔质量为g/mol;
-
(2) 该气体的物质的量为mol;
-
(3) 该气体在标准状况下的体积为L;
-
(4) 该气体在标准状况下的密度为g/L;
-
(5) 该气体所含原子总数为个;
-
(6) 该气体的一个分子的质量为g.
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 标准状况下,32gSO3的体积约为11.2L
B . 2.0gH218O与D2O的混合物中所含中子数为NA
C . 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D . 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
同温、同压时质量相等的O2和O3相比较,其物质的量之比为,体积之比为密度之比为,所含氧原子数之比为
利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
-
(1) NH3的摩尔质量是,0.2 mol氨气中含的NH3分子数是,含有电子的物质的量是。
-
(2) 在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是。
-
(1) 同温同压下,有0.3molO2与0.2molO3 , 它们的质量之比为,它们的体积之比为,它们的密度之比为。
-
(2) 现有一定条件下CO2 和 H2O 的混合气体37.5g,通过足量的Na2O2固体后,剩余的气体在标准状况的体积为11.2L,则:混合气体中CO2的物质的量为mol,混合气体中H2O的质量为g。
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1mol N2 , 右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A . 右边CO与CO2分子数之比为1:3
B . 右侧CO的质量为2.75g
C . 若改变右边CO和CO2的充入量而使隔板处于离右端1/6处,保持温度不变,则前后两次充入容器内的气体压强之比为5: 3
D . 右侧气体密度是相同条件下氢气密度的16倍
分别装在体积相同容器中的乙烯和丙烯,一定具有相同的( )
A . 质量
B . 分子数
C . 碳碳双键数
D . 含碳量
下列叙述正确的是( )
A . 与28 g CO具有相同分子数的CO2的质量一定是44 g
B . 与V L CO具有相同分子数的CO2的体积一定是V L
C . 所含原子数相等的CO与CO2的密度之比为7∶11
D . 所含原子数相等的CO与CO2的密度之比为21∶22
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧充入1 mol N2 , 右侧充入CO和CO2的混合气体共8 g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
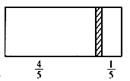
A . 右侧CO与CO2分子数之比为1∶3
B . 右侧气体密度是相同条件下氢气密度的18倍
C . 右侧CO的质量为1.75 g
D . 若隔板处于距离右端1/6处,其他条件不变,则前后两次压强之比为25∶24
下列叙述错误的是( )
A . 标准状况下,5LCH4气体与5L NH3气体的原子个数之比为5:4
B . 常温常压下,11.2LO3中所含氧原子个数小于1.5NA
C . 同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度
D . 同温、同压下,等质量的一氧化碳和二氧化碳的密度比为11:7
NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 标准状况下,22.4L盐酸含有NA个HCl分子
B . 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
C . 1molNa被完全氧化生成Na2O2 , 失去2NA个电子
D . 电解精炼铜时,若转移了NA个电子,则阳极溶解32g铜
已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A . 常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B . CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为  C . 标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D . 常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
C . 标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D . 常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
 C . 标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D . 常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
C . 标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D . 常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
下列说法错误的是( )
A . 温度相同、体积相同的O2(g)和N2(g)所含的分子数一定相同
B . 等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C . 温度和容积相同的两容器中分别盛有5molO2和2molN2 , 则压强之比为5∶2
D . 等温等压条件下,3molO2(g)和2molH2(g)的体积之比等于3∶2
-
(1) CH4的空间构型呈(用文字描述)。
-
(2) 0.5molO2的质量为g,在标准状况下的体积约为L,同温同压下,O2和O3的密度之比为。
-
(3) 氧元素的一种核素,核内有10个中子,该核素的符号可表示为。
-
(4) KClO3在水中的电离方程式是。
-
(5) 用单线桥法标出下列反应电子转移的方向和数目:。
6Fe2++Cr2O
 +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
完成下列问题。
-
(1) 常温常压下,用等质量的
 、CO、
、CO、 、
、 四种气体分别吹出四个气球。其中气体为
四种气体分别吹出四个气球。其中气体为 的是____(填序号)。
A .
的是____(填序号)。
A . B .
B .  C .
C .  D .
D . 
-
(2) 在标准状况下,2.24L由
 、
、 组成的混合气体中含有的氮元素的质量约为。
组成的混合气体中含有的氮元素的质量约为。
-
(3) 在0.1L由KCl、
 、
、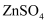 形成的植物营养液中,
形成的植物营养液中,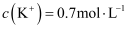 ,
, 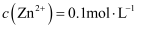 ,
, 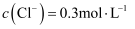 , 向混合溶液中滴加足量的
, 向混合溶液中滴加足量的 溶液后产生沉淀的物质的量为。
溶液后产生沉淀的物质的量为。
-
(4) 在干燥烧瓶中用向下排空气法收集氨气(已知:空气不可能排净,空气的平均相对分子质量为29,瓶内气体对氢气的相对密度为9.5,氨气极易溶于水),将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的。
-
(5) 100mL0.3

 溶液(密度为
溶液(密度为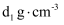 , )和50mL0.2
, )和50mL0.2
 溶液(密度为
溶液(密度为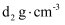 )的混合,所得密度为
)的混合,所得密度为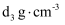 的混合溶液中
的混合溶液中 的浓度为(用含d1、d2、d3的式子表示)。
的浓度为(用含d1、d2、d3的式子表示)。
化学计量在化学中占有重要地位。回答下列问题:
-
(1) 相同质量SO2和SO3所含的原子个数比是。
-
(2) 同温同压下,等体积的N2和O2的质量之比为。
-
(3) 溶质质量为29.4 g的硫酸溶液中含有mol SO
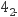 。
。
-
(4) 标准状况下6.72 L NH3分子中所含原子数与g H2O所含原子数相等。
-
(5) 0.5 L 1 mol·L-1 FeCl3溶液与0.2 L 1 mol· L-1 KCl 溶液中的Cl-的数目之比为。
-
(6) 用MnO2和浓盐酸制取氯气,当4 mol氯化氢被氧化时,生成的氯气的体积(标况)是。
同温同压下,等质量的CO、CO2气体,下列物理量中CO<CO2的是( )
A . 分子数
B . 体积
C . 摩尔体积
D . 密度
最近更新



