粗盐提纯 知识点题库
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行以下五项操作:①过滤;②加过量NaOH溶液;③加适量稀盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液,正确的是
A . ①④②⑤③
B . ④①②⑤③
C . ②⑤④①③
D . ②④⑤①③
为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列六步操作,下列各组操作顺序合理的是( )
①过滤,
②加稍过量的NaOH溶液,
③向滤液中加适量盐酸,
④加稍过量的Na2CO3溶液,
⑤加稍过量的BaCl2溶液,
⑥将滤液蒸发结晶.
A . ②④⑤①③⑥
B . ⑤②④①③⑥
C . ④②⑤①③⑥
D . ②⑤④③①⑥
食盐是人类生活中不可缺少的物质,海水中含有大量食盐.某地出产的粗盐中,所含杂质是CaCl2 , 通过下面的实验可制得纯净的NaCl.

-
(1) 加入的A是 ,检验A已过量的方法是
-
(2) 加入的B是 ,加入稍过量B的目的是
-
(3) 为检验沉淀是否洗净,最好在最后几滴洗出液中加入 溶液
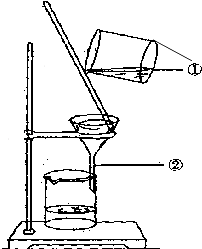
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
-
(1) 写出标号的仪器名称:
①,②;
-
(2) 过滤时起引流作用,玻璃棒靠层滤纸,漏斗中液体的液面应该低于的边缘(选 漏斗 或 滤纸);
-
(3) 蒸发滤液时,用玻璃棒不断搅拌的目的是;等到蒸发皿中出现较时,停止加热,但要用玻璃棒继续,利用蒸发皿的余热使滤液蒸干.移去蒸发皿时所使用的仪器是.
-
(4) 若粗盐质量是6g,精盐质量是5g,那么精盐的产率=
 ×100%=.
×100%=.
粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42﹣等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳、稀盐酸.
-
(1) 欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42﹣ , 选出a所代表的试剂,按滴加顺序依次为 (只填化学式).
-
(2) 如何检验SO42﹣是否沉淀完全.
-
(3) 调节pH 的目的,试剂b是(填名称).
-
(4) 洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为,使用该试剂的目的是.
回答下列问题
-
(1) 下列仪器常用于物质分离的是.

-
(2) 在粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,试分别说明在这三种情况下使用玻璃棒的作用.
溶解时:;过滤时;蒸发时:.
-
(3) 从精制的食盐溶液中获得食盐晶体的操作中,除了铁架台、玻璃棒外、还需要的仪器
-
(4) 粗食盐中含有钙离子,某学生用Na2CO3使Ca2+离子转化为沉淀而除去,说明Ca2+离子完全被除去的实验操作.
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
不正确的操作顺序是( )
A . ③②①⑤④
B . ②③①⑤④
C . ③①②⑤④
D . ①②③⑤④
实验室里由粗盐制备精盐的实验中,必需的操作步骤有( )
A . 分液
B . 过滤
C . 溶解
D . 蒸发结晶
小苏打是一种常用的食品添加剂。
-
(1) 精制食盐是制备小苏打的原料之一。粗盐中含有少量Ca2+、Mg2+、SO42- , 粗盐精制的步骤顺序是:溶解→→→→ (填字母编号)。
a.加盐酸调pH
b.加Ba(OH)2溶液
c.加Na2CO3溶液
d.过滤
-
(2) NH3、CO2先后通入饱和食盐水中,反应的离子方程式。
-
(3) 侯氏制碱法中,母液的处理方法是通入氨气,再加入细小食盐颗粒,最后冷却析出的副产品是;简述通氨气的作用。
-
(4) 称取2.640 g小苏打样品(含少量NaCl),配置成250 mL溶液,准确取出20.00 mL溶液于锥形瓶中,滴加作指示剂,滴定时消耗0.1000 mol/L盐酸的体积为20.67 mL。则该样品中碳酸氢钠的质量分数为(保留两位小数)。若装标准溶液的滴定管没有润洗,则测得的结果会(填“偏大”、“偏小”或“不变”)。
-
(5) 测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。实验需使用的定量仪器是;写出涉及的化学方程式。

过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的NaOH溶液; ② 加入稍过量的Na2CO3溶液; ③ 加入稍过量的BaCl2 溶液; ④ 滴入稀盐酸至无气泡产生; ⑤ 过滤正确的操作顺序是 ( )
A . ③①②⑤④
B . ②③①④⑤
C . ②③①⑤④
D . ③⑤②①④
粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,为除去上述杂质离子,可供选用的试剂有:①稀盐酸 ②Na2CO3溶液 ③BaCl2溶液 ④NaOH溶液,上述四种溶液的加入顺序不合理的是( )
A . ②③④①
B . ③②④①
C . ③④②①
D . ④③②①
根据已经学过的化学知识,回答下列问题。
-
(1) I.现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是(填序号,下同);上述物质中不能导电,但属于电解质的是。
-
(2) NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式 。
②与0.1 mol·L-1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为。
-
(3) 粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是。
-
(4) II.A,B,C,X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
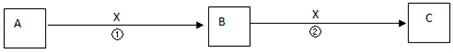
若X是氧气,则A不可能 (填序号)
A.C B.Si C.Na D.Mg
-
(5) 若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)。检验B溶液中阳离子的操作方法是。
-
(6) 若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为。
粗盐中含有少量的Ca2+、Mg2+、SO42- , 欲除去这些杂质,正确添加试剂及操作的顺序为:、NaOH溶液、、、。
海水通过晾晒可得粗盐,粗盐中除含有NaCl外,还含有MgCl2 , CaCl2 , Na2SO4以及少量泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:

-
(1) 在第②步过滤操作中要用玻璃棒,作用是。
-
(2) 在第③步操作的目的是除去粗盐中的(填化学式,下同),第⑦步操作的目的是除去滤液中的。
-
(3) 第⑥步操作中得到沉淀的成分有:BaSO4、Mg(OH)2、(填化学式)。
-
(4) 在第⑤步操作中,选择的除杂试剂Na2CO3不能用K2CO3代替,理由是。
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。下列说法错误的是( )

A . 可以利用反渗透膜从海水中分离出淡水
B . 粗盐中含有Ca2+、Mg2+、SO  等杂质离子,精制时加入试剂的顺序可以是氯化钡溶液、氢氧化钠溶液 、碳酸钠溶液 、稀盐酸
C . 提取溴时,已经获得Br2又将Br2还原为Br- , 其目的是富集溴元素
D . 提取镁时,从Mg (OH)2只需一步反应即可得到Mg单质
等杂质离子,精制时加入试剂的顺序可以是氯化钡溶液、氢氧化钠溶液 、碳酸钠溶液 、稀盐酸
C . 提取溴时,已经获得Br2又将Br2还原为Br- , 其目的是富集溴元素
D . 提取镁时,从Mg (OH)2只需一步反应即可得到Mg单质
 等杂质离子,精制时加入试剂的顺序可以是氯化钡溶液、氢氧化钠溶液 、碳酸钠溶液 、稀盐酸
C . 提取溴时,已经获得Br2又将Br2还原为Br- , 其目的是富集溴元素
D . 提取镁时,从Mg (OH)2只需一步反应即可得到Mg单质
等杂质离子,精制时加入试剂的顺序可以是氯化钡溶液、氢氧化钠溶液 、碳酸钠溶液 、稀盐酸
C . 提取溴时,已经获得Br2又将Br2还原为Br- , 其目的是富集溴元素
D . 提取镁时,从Mg (OH)2只需一步反应即可得到Mg单质
海水的综合利用包括很多方面,下图是一种海水综合利用联合工业体系的简易示例图。

回答下列问题:
-
(1) 实验室中由粗盐制取精盐的过程中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是。
-
(2) 电解饱和食盐水的离子方程式为。
-
(3) 在溴工业中富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为。
-
(4) 镁工业为使苦卤中的Mg2+完全转化为Mg(OH)2(离子浓度小于10-5 mol·L-1时,沉淀就达完全),溶液的pH至少要控制在[常温下,Mg(OH)2的Ksp≈1×10-11];Mg(OH)2沉淀完全后,过滤,沉淀用盐酸酸化,从MgCl2溶液制得无水MgCl2 , 应如何操作。
-
(5) 海水中也有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如下图所示:
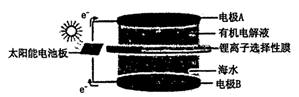
①金属锂在电极(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是。
粗盐含有泥沙以及Ca2+、Mg2+、SO42﹣等杂质,其提纯过程一般经过以下流程:

某兴趣小组按上述方案进行粗盐提纯实验,实验室提供了粗盐样品、稀盐酸、NaOH溶液、BaCl2溶液、Na2CO3溶液等药品以及必备的实验仪器若干。请回答下列问题:
-
(1) 操作①粗盐样品加水之前,需要将大颗粒粗盐变为细小颗粒或粉末,此时在实验室中需要用到的仪器为。
-
(2) 操作②、④过滤后的滤液仍有浑浊,需要进行的操作是。
-
(3) 操作③按abc顺序依次加入过量的试剂。若a为NaOH溶液,则c为。加入c发生反应的离子方程式为。
-
(4) 加盐酸调溶液pH的目的是。
-
(5) 步骤⑥操作名称是。
粗盐中含有泥沙以及 、
、 、SO
、SO 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程:
 、
、 、SO
、SO 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程:
某兴趣小组按上述方案进行粗盐提纯实验,实验室提供了粗盐样品、稀盐酸、NaOH溶液、BaCl2溶液、Na2CO3溶液等药品以及必备的实验仪器若干。请回答下列问题:
-
(1) 操作②、④过滤后的滤液仍有浑浊,需要进行的操作是。
-
(2) 操作③按a、b、c顺序依次加入过量的试剂。若a为NaOH溶液,则c为。加入c发生反应的离子方程式为。
-
(3) 加盐酸调溶液pH的目的是。
-
(4) 步骤⑥操作名称是。
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过如图操作流程:

-
(1) 操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、埚埚钳外,还需要用到的仪器是
-
(2) 实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是____(填字母)。A . 粗盐没有全部溶解即过滤 B . 蒸发时有液滴飞溅 C . 蒸发后所得“精盐”很潮湿 D . 蒸发皿上粘有的“精盐”没有全部转移到称量纸上
-
(3) 小明查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的
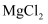 、
、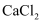 、
、 等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
提供的试剂:
 溶液、
溶液、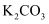 溶液、
溶液、 溶液、
溶液、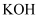 溶液、
溶液、 和
和 溶液。
溶液。①从提供的试剂中选择,a所代表的试剂是、、
 溶液(各试剂均稍过量)。
溶液(各试剂均稍过量)。②判断“滤液I中
 是否已除尽操作是.
是否已除尽操作是.③在“滤液2”中加盐酸的作用是、(用化学方程式表示)。
食盐是有钠元素和氯元素组成的日常生活中使用最为广泛的调味品。从海水得到的粗食盐水中常含Ca2+、Mg2+、 , 需要分离提纯。现有含少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取较纯净的食盐、某学生小组设计的提纯操作步骤和加入试剂的情况如图。
, 需要分离提纯。现有含少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取较纯净的食盐、某学生小组设计的提纯操作步骤和加入试剂的情况如图。
 , 需要分离提纯。现有含少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取较纯净的食盐、某学生小组设计的提纯操作步骤和加入试剂的情况如图。
, 需要分离提纯。现有含少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取较纯净的食盐、某学生小组设计的提纯操作步骤和加入试剂的情况如图。
-
(1) 第①步蒸馏水溶解粗盐后,获得“液体(浓)”的操作名称为,沉淀A的化学式。
-
(2) 写出第⑤步操作中可能发生反应的离子方程式:;。
-
(3) 请写出操作第④、⑤步所加试剂名称:④;⑤。
-
(4) 有同学认为上述实验设计步骤可以简化,请你提出一种设想;。
最近更新



