相对分子质量的测定 知识点题库
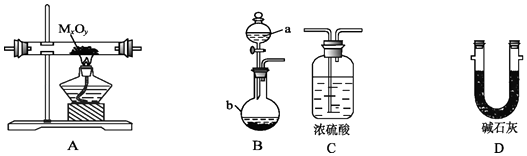
-
(1) 仪器a的名称为,仪器b中装入的试剂可以是.
-
(2) 按气流方向正确的装置连接顺序为(填序号,装置可重复使用):.
-
(3) 装置C的作用:.
-
(4) 实验结束时,应首先(填序号); 这样做的原因是.
Ⅰ.熄灭A装置的酒精灯Ⅱ.停止从a中滴加液体
-
(5) 若金属氧化物为CuO,反应的化学方程式为
-
(6) 若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为(用含x、y、m、n的式子表示).
-
(7) 某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进?.
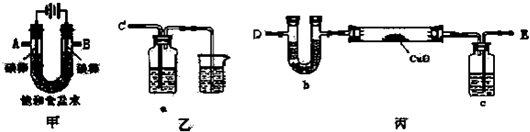
-
(1) 为完成上述实验,正确的连接顺序为 接A,B接(填写连接的字母).
-
(2) 对硬质玻璃管里的氧化铜粉末加热前,需要的操作为.
-
(3) 若检验氯气的氧化性,则乙装置的a瓶中溶液及对应的现象是.
-
(4) 为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量.
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量.
② 请你分析并回答:你认为不合理的方案及其不足之处是.
②按测得结果更准确的方案进行计算,Cu的相对原子质量.
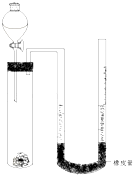
①准确称量m g金属镁(已除去表面氧化膜),用铜网包住放入干净的试管中;
②按图示组装好装置,然后在关闭活塞的分液漏斗中装入一定体积2mol/L的盐酸;
③调整右边玻璃管(带均匀刻度值),让U型管两端液面在同一水平面,读出右边玻璃管的液面刻度值为V1mL;
③ 打开分液漏斗活塞,让一定量的盐酸进入试管中后立即关闭活塞;
④ 当镁条反应完后,等装置冷却至室温后,再上下调节右边玻璃管的高度,使两端管内液面在同一水平面,读出右边玻璃管的液面刻度为V2mL,
请回答下列问题:
-
(1) 写出你认为步骤⑤中空格应进行的操作.
-
(2) 若V1、V2均是折算为标况下的值,则镁的相对原子质量Ar(Mg)的实验测定表达式为Ar(Mg)=,你认为此表达式求出的值是否准确?(填‘是’或‘不’),主要问题为(若回答‘是’则此空不填).
-
(3) 步骤①中,为什么要用铜网包住镁条?.
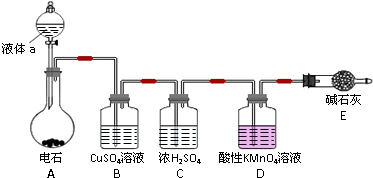
-
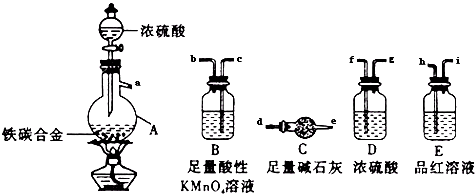
(1) 实验室制取乙炔时,分液漏斗中的液体a通常是.
-
(2) CuSO4溶液的作用是.
该小组实验如下:实验前,D装置中KMnO4的物质的量为x mol.实验完毕,D及E装置的总质量共增重y g,此时D中过量的KMnO4恰好能与含z mol FeSO4的溶液完全反应(注:反应中MnO4﹣被还原成Mn2+ , Fe2+被氧化成Fe3+).则所测乙炔的相对分子质量是(请用含字母x、y、z的代数式表示).
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g/cm3 . 该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX.为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入大试管中;
②在大试管中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应(如图所示);

③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液,得白色沉淀;
④过滤,洗涤,干燥后称重,得到c g固体.
回答下面问题:
-
(1) 装置中长玻璃管的作用是;
-
(2) 该卤代烃中所含卤素的名称是,判断依据是;
-
(3) 该卤代烃的相对分子质量是(列出算式);如果在步骤③中加HNO3的量不足,没有将溶液酸化,则步骤④中测得的c值(填选项代码).
A.偏大 B.偏小 C.不变.
-
(1) 将2.225g固体油脂样品与25.00mL 0.5000mol/L的烧碱溶液混合后加热3小时,加热装置如图2所示.
写出油脂在热烧碱溶液中发生皂化反应的化学方程式.
-
(2) 竖直长导管的作用是.由于油脂不溶于水,为使反应物充分接触,可往容器内加入一定量的(选填编号).
a.苯b.四氯化碳c.乙醇d.氯仿
-
(3) 为测定油脂的平均分子量,往皂化后的溶液中加入几滴酚酞作指示剂,用0.2500mol/L的标准盐酸溶液中和过量的烧碱,当时到达滴定终点,共消耗盐酸20.00mL.由上述实验可计算该油脂样品的平均分子量为.
若滴定时少加一滴标准盐酸(0.04mL),则滴定的相对误差为.
-
(4) 配制0.25mol/L标准盐酸溶液所用仪器除了500mL容量瓶、量筒、烧杯外,还需要、(填仪器名称).
-
(5) 若用12mol/L的浓盐酸进行稀释配制,则量筒的规格最好选用(选填编号).
a.10mL b.25mL c.50mL d.100mL
-
(6) 滴定时若用甲基橙作指示剂,则最终测定结果(油脂的平均分子量)(填“偏大”、“偏小”或“无变化”).
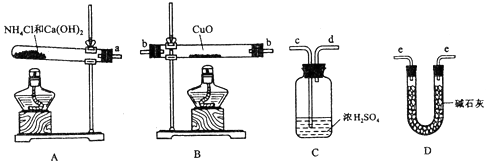
请回答下列问题:
-
(1) 氨气还原炽热氧化铜的化学方程式为;
-
(2) 从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→;
-
(3) 在本实验中,若测得m(CuO)=a g,m(H2O)=b g,则Ar(Cu)=;
-
(4) 在本实验中,使测定结果Ar(Cu)偏大的是 (填序号);
①CuO未完全起反应
②CuO不干燥
③CuO中混有不反应的杂质
④碱石灰不干燥
⑤ NH4Cl与Ca(OH)2混合物不干燥.
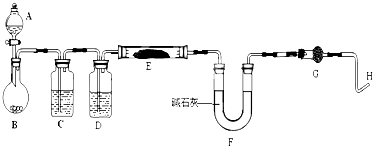
请回答下列问题:
-
(1) 仪器中装入的试剂:C、D;
-
(2) 连接好装置后应首先进行的操作是;
-
(3) “加热反应管E”和“从A中逐滴滴加液体”这两步操作应该先进行的是,在这两步之间还应进行的操作是;
-
(4) 干燥管G的作用是,反应过程中H管逸出的气体的处理方法是;
-
(5) 从实验中测得了下列数据:①空E管的质量ag,②反应前E管和WO3的总质量bg,③反应后E管和W粉的总质量cg(冷却到室温称量),④反应前F管及内盛物的总质量dg,⑤反应后F管及内盛物的总质量eg.
由以上数据可以列出计算W相对原子质量的两个不同计算式(除W外,其它涉及的元素的相对原子质量均为已知):计算式1:Ar(W)=;计算式2:Ar(W)=
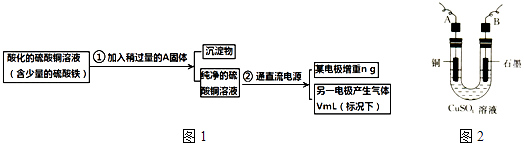
回答下列问题:
-
(1) 步骤①中加入的A是,作用是:.
-
(2) 电解开始后,在U形管中可以观察到的现象有:.电解的离子方程式为.
-
(3) 下列实验操作中必要的是(填写字母).
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法.
-
(4) 铜的相对原子质量为(用带有n、V的计算式表示).
 3Cu+N2+3H2O,某课外小组利用图装置测定Cu的相对原子质量.(图中夹持、固定装置已略去)
3Cu+N2+3H2O,某课外小组利用图装置测定Cu的相对原子质量.(图中夹持、固定装置已略去) 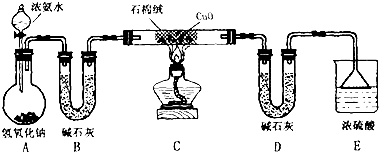
回答下列问题:
-
(1) 实验步骤
①按图连接好装置并检验气密性.
②称取CuO粉末m1g置于硬质玻璃管内的石棉绒上,装有碱石灰的装置D的质量为m2g,其它装置按图所示装好药品.
③打开分液漏斗旋塞,点燃酒精灯.
④当观察到装置C中出现现象时,熄灭酒精灯,几分钟后,再关闭分液漏斗旋塞.
⑥ 反应结束后测得装置D的总质量为m3g.
-
(2) 问题与讨论
①装置E的作用
②Cu的相对原子质量(用含m1、m2、m3的代数式表示).
③如果去掉B装置,则测定结果将(填“偏大”、“不变”、“偏小”)
-
(3) 实验反思
课外小组同学认为装置C中CuO粉末是否完全反应是实验的关键.实验结束后,请设计一种实验方案,用化学方法证明CuO粉末已完全反应:.
Ⅰ探究浓硫酸的某些性质
-
(1) 该装置的链接顺序a
-
(2) 点燃酒精灯一段时间后,A中可观察到明显的现象.写出A中发生反应的化学方程式、.
-
(3) 反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是.
Ⅱ测定铁的质量分数
-
(4) 待A中不再逸出气体时,停止加热,拆下C并称重.C增重b g.铁碳合金中铁的质量分数为(写表达式).
-
(5) 某同学认为上述方法较复杂,而且测出的数值可能偏大,其原因.
-
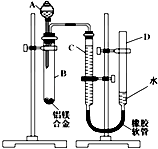
(1) A中试剂为
-
(2) 实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是.
-
(3) 检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不 再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂;
上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应.
-
(4) B中发生反应的化学反应方程式:
-
(5) 若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B 中剩余固体的质量为c g,则铝的相对原子质量为(用含a、b、c的式子表示计算结果).
-
(6) 实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将.(填“偏大”、“偏小”或“不受影响”)
-
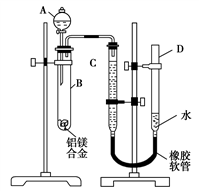
(1) A中试剂为。
-
(2) 实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是。
-
(3) 检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是(填序号);记录C的液面位置时,除平视外,还应。
-
(4) B中发生反应的化学方程式为。
-
(5) 若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为。
-
(6) 实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将(填“偏大”“偏小”或“不受影响”)。
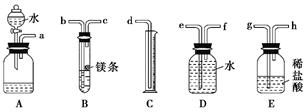
填写下列各项(气流从左到右):
-
(1) 各种仪器连接的先后顺序是接、接、接、接(用小写字母表示)。
-
(2) 连接好仪器后,要进行的操作有以下几步,其先后顺序是(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为V0 mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为w g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水V1mL。
-
(3) 根据实验数据可算出金属镁的相对原子质量,其数学表达式为。
-
(4) 若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据(填“偏大”“偏小”或“无影响”)。
-
(5) 仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如图所示的实验装置。
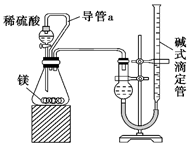
装置中导管a的作用是。
 +2MnO
+2MnO  +16H+=10CO2+2Mn2++8H2O,下列说法正确的是( )
+16H+=10CO2+2Mn2++8H2O,下列说法正确的是( )
 的物质的量为0.06mol
B . 配制草酸合铁酸钾溶液,玻璃仪器只需要烧杯和玻璃棒
C . 该晶体的化学式为K3Fe(C2O4)3·6H2O
D . 9.820g样品中含K+的物质的量为0.06mol
的物质的量为0.06mol
B . 配制草酸合铁酸钾溶液,玻璃仪器只需要烧杯和玻璃棒
C . 该晶体的化学式为K3Fe(C2O4)3·6H2O
D . 9.820g样品中含K+的物质的量为0.06mol
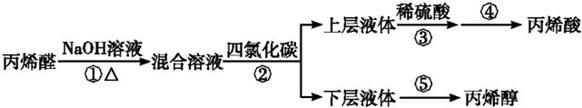
已知:
①2CH2=CH—CHO+NaOH  CH2=CHCH2OH+CH2=CHCOONa
CH2=CHCH2OH+CH2=CHCOONa
②2CH2=CHCOONa+H2SO4  CH2=CHCOOH+Na2SO4
CH2=CHCOOH+Na2SO4
③有关物质的相关性质如表:
| 物质 | 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
| 沸点/ ℃ | 53 | 97 | 141 | 77 |
| 熔点/ ℃ | -87 | -129 | 13 | -22.8 |
| 密度/(g·mL-1) | 0.84 | 0.85 | 1.02 | 1.58 |
| 溶解性(常温) | 易溶于水 和有机溶剂 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水 |
-
(1) 操作①需要连续加热30 min,所用装置如图所示。仪器L名称是。
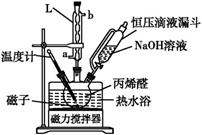
-
(2) 操作②使用的主要仪器是分液漏斗,在使用之前需进行的操作是。
-
(3) 操作④包括、过滤、冰水洗涤、低温吸干。
-
(4) 操作⑤中,加热蒸馏“下层液体”,分离出四氯化碳;再分离出丙烯醇(如图),要得到丙烯醇应收集(填温度)的馏分。图中有一处明显不正确,应改为。

-
(5) 测定丙烯醇的摩尔质量:准确量取a mL丙烯醇于分液漏斗中,烧瓶内盛装足量钠粒。实验前量气管B中读数为b mL,当丙烯醇完全反应后,冷却至室温、调平B、C液面,量气管B的读数为c mL。已知室温下气体摩尔体积为V L·mo
 。
。 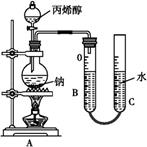
调平B、C液面的操作是;实验测得丙烯醇的摩尔质量为 g·mo
 (用代数式表示)。如果读数时C管液面高于B管;测得结果将(填“偏大”“偏小”或“不变”)。
(用代数式表示)。如果读数时C管液面高于B管;测得结果将(填“偏大”“偏小”或“不变”)。
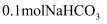 恰好完全反应,下列有关M的说法中错误的是( )
恰好完全反应,下列有关M的说法中错误的是( )



